COMO AS LIGAÇÕES ACONTECEM
Para formar as moléculas, os átomos fazem ligações entre si.
No módulo anterior, vimos os tipos de ligações. Essas ligações são feitas entre os elétrons da última camada do átomo.
Para isso, precisamos saber QUANTOS ELÉTRONS tem na última camada.
Se for um átomo, o número de elétrons é igual ao número de prótons que é igual ao número atômico.( Z )
A forma de saber é usando o diagrama de Pauling, que trabalha com os níveis energéticos de um átomo.
Níveis e Subníveis Atômicos
Os níveis e subníveis atômicos são conceitos fundamentais para entender a distribuição dos elétrons em um átomo.
- Níveis Atômicos:
- Os níveis atômicos (ou camadas eletrônicas) são regiões ao redor do núcleo onde os elétrons estão distribuídos. Eles são identificados por números principais (n), que vão de 1 para o nível mais próximo ao núcleo até valores maiores para níveis mais distantes. São eles :
- K= 2 elétrons no máximo – possui o subnível s² ( esse número acima da letra representa o número de elétrons)
- L= 8 elétrons, no máximo -possui os subníveis s² p6 ⇒ 6+2 = 8 elétrons
- M=18 elétrons, no máximo – possui os subníveis s² p6 d10 ⇒ 2+6+10 = 18 elétrons
- N=32 elétrons, no máximo – possui os subníveis s² p6 d10 f14 ⇒ 2+ 6+ 10+ 14 = 32 elétrons
- O= 32 elétrons, no máximo – possui os subníveis s² p6 d10 f14
- P=18 elétrons , no máximo – possui os subníveis s² p6 d10
- Q= 8 elétrons , no máximo – possui os subníveis s² p6
- Subníveis Atômicos:
- Cada nível atômico é subdividido em subníveis, que são designados por letras: s, p, d e f.
- Subnível s: Tem forma esférica e pode conter até 2 elétrons.
- Subnível p: Tem forma de lóbulos e pode conter até 6 elétrons.
- Subnível d: Tem forma mais complexa e pode conter até 10 elétrons.
- Subnível f: Também tem forma complexa e pode conter até 14 elétrons.
-
- DIAGRAMA DE PAULING
-
DIAGRAMA DE PAULING – mostrando os níveis ou camadas: K,L,M,N,O,P,Q . O número de elétrons em cada camada, os subníveis de cada camada e como utilizar: sempre de cima para baixo, na diagonal. imagem: Facebook - Os subníveis são organizados dentro dos níveis principais. Por exemplo, o nível 2 possui dois subníveis: 2s e 2p. O nível 3 possui três subníveis: 3s, 3p e 3d.
- Cada nível atômico é subdividido em subníveis, que são designados por letras: s, p, d e f.
Exemplos
- Átomo de Carbono (C):
- Número atômico: 6.
- Distribuição eletrônica: 1s² 2s² 2p². 4 elétrons na última camada
- No nível 1: 1s² (2 elétrons).
- No nível 2: 2s² 2p² (8 elétrons).
- Átomo de Ferro (Fe):
- Número atômico: 26.
- Distribuição eletrônica: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶.
- No nível 1: 1s² (2 elétrons).
- No nível 2: 2s² 2p⁶ (8 elétrons).
- No nível 3: 3s² 3p⁶ 3d⁶ (18 elétrons).
- No nível 4: 4s² (2 elétrons). 2 elétrons na última camada
Diagrama de Pauling
O Diagrama de Pauling é uma ferramenta útil para visualizar a ordem de preenchimento dos subníveis na construção da distribuição eletrônica dos átomos. Ele mostra a sequência na qual os subníveis são preenchidos com elétrons, o que ajuda a determinar a configuração eletrônica dos átomos.
-
- O diagrama apresenta linhas diagonais que conectam diferentes subníveis. A ordem das linhas indica a sequência de preenchimento dos subníveis de acordo com o princípio de Aufbau, que afirma que os elétrons ocupam os subníveis de menor energia primeiro.
- A ordem de preenchimento geralmente segue a sequência: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p.
A última camada, chamada camada de valência, é a camada mais externa onde os elétrons mais distantes do núcleo estão localizados. O número de elétrons na última camada pode ser diretamente lido a partir da configuração eletrônica do átomo.
Exemplo
Para o átomo de oxigênio (O) com número atômico 8:
- Configuração eletrônica: 1s² 2s² 2p⁴.
- Número de elétrons em cada camada:
- Camada K: 2 elétrons.
- Camada L: 6 elétrons (2s² 2p⁴).
- Número de elétrons na última camada (camada L): 6.
Sabendo o número de elétrons em cada camada de valência, as ligações ficam melhor entendidas:
LIGAÇÃO IÔNICA – famílias 1,2,3 doam elétrons .Respectivamente 1, 2 ,3 elétrons.
Famílias 5,6,7 recebem elétrons- respectivamente 3,2,1 elétrons .
OBSERVE:
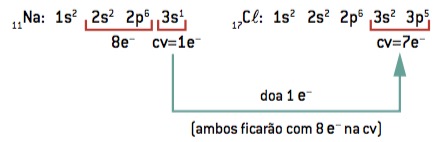
NÃO ESQUEÇA: FAMÍLIAS A – 1A TEM 1 ELÉTRON NA ÚLTIMA CAMADA.
2A TEM 2 ELÉTRONS NA ÚLTIMA CAMADA , E ASSIM POR DIANTE ATÉ A FAMÍLIA 8A QUE TEM 8 ELÉTRONS NA ÚLTIMA CAMADA : É UM GÁS NOBRE , NÃO FAZ LIGAÇÕES COM OUTROS ELEMENTOS. TODOS OS OUTROS ÁTOMOS FAZEM LIGAÇÕES PORQUE QUEREM CHEGAR NESSA CONFIGURAÇÃO!!
EXEMPLO:
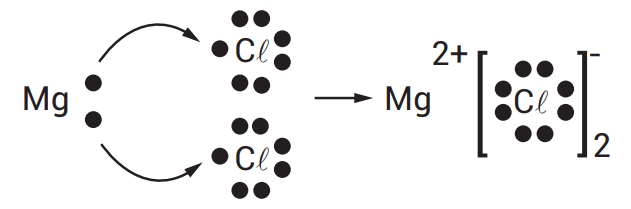
EXEMPLOS:

DICA: SE VOCÊ PENSAR UM POUCO, VAI CHEGAR À CONCLUSÃO QUE, NAS FÓRMULAS, QUEM DÁ ELÉTRONS É ION POSITIVO. QUEM RECEBE ELÉTRONS É ION NEGATIVO. AS FÓRMULAS SEMPRE COMEÇAM PELO POSITIVO. VEJA ABAIXO:
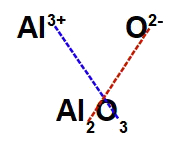
RESUMO