Depois de saber como os átomos se ligam, formando moléculas, agora entender que tipo de substâncias são formadas com as combinações entre os átomos da tabela periódica! Já deu para perceber que são MUITAS combinações!
AS FUNÇÕES INORGÂNICAS – UMA BREVE EXPLICAÇÃO DE TODAS .
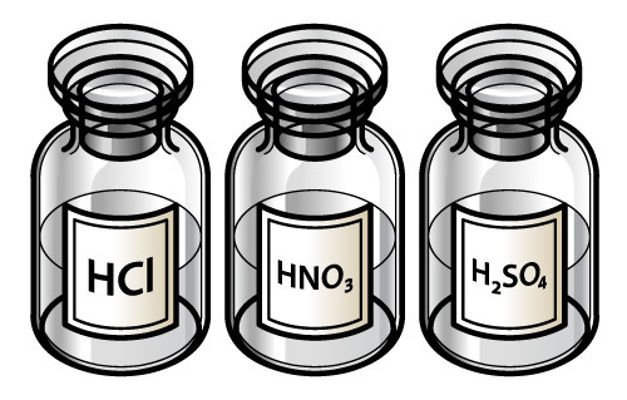
1. Ácidos
Propriedades
- Sabor: Azedo (como o ácido cítrico no limão).
- Cor: Podem mudar a cor de indicadores. Por exemplo, o ácido torna o tornassol ( papel usado em laboratório para indicar se uma substância é acida ou básica) azul em vermelho.
- Condutividade: São bons condutores de eletricidade em solução aquosa.
- Reatividade: Reagem com metais para liberar hidrogênio e com bases para formar sais e água.
Como se Apresentam
- Forma: Normalmente líquidos ou sólidos cristalinos. Por exemplo, o ácido clorídrico (HCl) é um líquido, enquanto o ácido acético (CH₃COOH) é um líquido em sua forma pura e sólido em algumas formas concentradas.
Ionização
- Ácidos fortes (como o ácido clorídrico, HCl) ionizam-se completamente em água, liberando muitos íons hidrogênio (H⁺).
- Ácidos fracos (como o ácido acético, CH₃COOH) ionizam-se parcialmente, liberando poucos íons H⁺.
Exemplos
- Ácido clorídrico (HCl): Utilizado em limpeza industrial e na produção de cloreto de sódio (sal de cozinha).
- Ácido sulfúrico (H₂SO₄): Usado em baterias de carro e na produção de fertilizantes.
- Ácido acético (CH₃COOH): Presente no vinagre, usado em conservas e na culinária.
- “Ácidos no dia a dia:
Fertilizantes e medicamentos: O ácido fosfórico (H3PO4) é muito utilizado na fabricação de fertilizantes e também como medicamento. É um dos vários ácidos que são utilizados na área farmacêutica.Frutas cítricas: possuem o ácido ascórbico (C6H8O6), também conhecido como vitamina C.
Vinagre: tem em sua composição ácido acético (CH3COOH).
Água com gás e refrigerantes: compostos por ácido carbônico (H2CO3), que dá ao produto a sensação de refrescância.” ( https://brasilescola.uol.com.br/quimica)
Aplicações
- Indústria alimentícia: Conservação de alimentos e bebidas.
- Indústria química: Produção de diversos produtos químicos.
- Medicina: Medicamentos e soluções para tratar problemas estomacais.
Principais Ácidos Inorgânicos
1. Ácido Clorídrico (HCl)
Ionização
- Ionização em Água: HCl é um ácido forte e ioniza-se completamente em água. HCl→ H+ + Cl−. Isso significa que, em solução aquosa, praticamente toda a molécula de HCl se dissocia em íons hidrogênio (H⁺) e cloreto (Cl⁻).
-

ácido clorídrico – ácido forte imagem: Manual da Química
Aplicações
- Indústria: Usado na limpeza de metais e na produção de cloreto de sódio (sal de cozinha) e outros produtos químicos.
- Laboratórios: Reagente comum em várias reações químicas.
- Tratamento de Água: Ajuste de pH e remoção de impurezas.
2. Ácido Sulfúrico (H₂SO₄)
Ionização
- Ionização em Água: H₂SO₄ é um ácido forte e ioniza-se completamente em duas etapas. Primeiro, dissocia-se em íons hidrogênio e íons sulfato (SO₄²⁻), e a segunda dissociação gera íons hidrogênio adicionais.
- H2SO4→
Aplicações
- Indústria: Produção de fertilizantes, baterias de carro, e detergentes.
- Química: Usado como desidratante e reagente em várias reações.
- Tratamento de Água: Ajuste de pH e remoção de metais pesados.
3. Ácido Nítrico (HNO₃)
Ionização
- Ionização em Água: HNO₃ é um ácido forte e ioniza-se completamente em água. HNO3→H+ + NO-³ Em solução aquosa, o ácido nítrico se dissocia completamente em íons hidrogênio (H⁺) e nitrato (NO₃⁻).
Aplicações
- Indústria: Produção de fertilizantes e explosivos (como TNT).
- Química: Usado na fabricação de corantes e em processos de nitrificação.
- Laboratórios: Reagente em várias análises e sínteses químicas.
4. Ácido Fosfórico (H₃PO₄)
Ionização
- Ionização em Água: H₃PO₄ é um ácido triprotico e ioniza-se : 3 H+ + PO4 -³
Aplicações
- Indústria: Produção de fertilizantes, alimentos e bebidas (como acidulante em refrigerantes).
- Química: Usado na fabricação de detergentes e como agente de limpeza em processos industriais.
- Saúde: Ingrediente em produtos de higiene e em tratamentos dentários.
5. Ácido Cloroso (HClO₂)
Ionização
- Ionização em Água: HClO₂ é um ácido fraco e ioniza-se parcialmente. HClO2↔ H+ + ClO²-
- Desinfetante: Usado em soluções desinfetantes e sanitizantes.
6. Ácido Hipocloroso (HClO)
Ionização
- Ionização em Água: HClO é um ácido fraco e ioniza-se parcialmente. HClO↔ H+ + ClO−
Aplicações
- Desinfetante: Usado em soluções para desinfetar água potável e em produtos de limpeza.
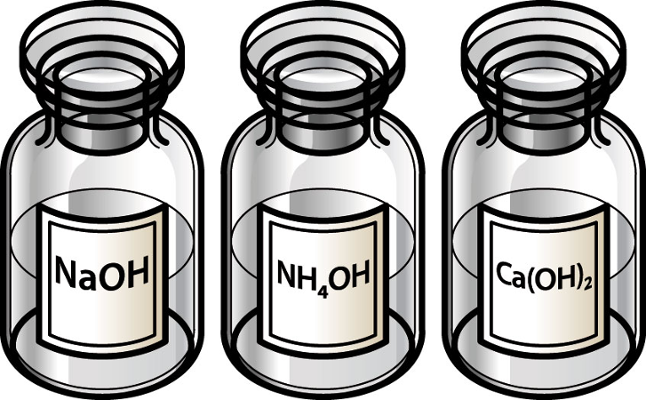
2. Bases
Propriedades
- Sabor: Amargo (como o hidróxido de sódio, NaOH, quando em pequenas quantidades).
- Cor: Mudam a cor dos indicadores. Por exemplo, tornam o tornassol vermelho em azul.
- Textura: Pode ter uma sensação escorregadia ao toque.
- Condutividade: Boas condutoras de eletricidade em solução aquosa.
- Reatividade: Reagem com ácidos para formar sais e água.
Como se Apresentam
- Forma: Normalmente sólidos cristalinos ou soluções aquosas. O hidróxido de sódio é um sólido branco, enquanto o hidróxido de potássio (KOH) é uma solução aquosa.
Ionização
- Bases fortes (como o hidróxido de sódio, NaOH) ionizam-se completamente em água, liberando muitos íons hidroxila (OH⁻).
- Bases fracas (como a amônia, NH₃) ionizam-se parcialmente, liberando poucos íons OH⁻.
Exemplos
- Hidróxido de sódio (NaOH): Usado em sabonetes, detergentes e processos industriais.
- Hidróxido de cálcio (Ca(OH)₂): Utilizado na agricultura para corrigir a acidez do solo.
- Amônia (NH₃): Usada em produtos de limpeza e fertilizantes.
Aplicações
- Limpeza: Produtos de limpeza e desengordurantes.
- Tratamento de água: Neutralização de ácidos e ajuste de pH.
- Indústria de alimentos: Ajuste de pH e processos de produção.
1. Hidróxido de Sódio (NaOH)
Ionização
- Ionização em Água: O hidróxido de sódio é uma base forte e ioniza-se completamente em água. NaOH→Na+ + OH−. Em solução aquosa, o NaOH se dissocia totalmente em íons sódio (Na⁺) e íons hidroxila (OH⁻).
Aplicações
- Indústria: Usado na fabricação de sabões, detergentes e papéis. Também é empregado na produção de produtos químicos como o cloreto de sódio (sal de cozinha) e o hidróxido de alumínio.
- Tratamento de Água: Ajuste do pH e neutralização de ácidos.
- Laboratórios: Reagente em várias reações químicas e titulações.
2. Hidróxido de Potássio (KOH)
Ionização
- Ionização em Água: O hidróxido de potássio é uma base forte e ioniza-se completamente em água. KOH→K+ + OH−. Em solução aquosa, o KOH se dissocia totalmente em íons potássio (K⁺) e íons hidroxila (OH⁻).
Aplicações
- Indústria: Usado na fabricação de sabões líquidos e fertilizantes. Também é utilizado em processos de limpeza e como reagente em sínteses químicas.
- Tratamento de Água: Ajuste do pH e neutralização de ácidos.
- Agricultura: Fertilizantes que fornecem potássio.
3. Hidróxido de Cálcio (Ca(OH)₂)
Ionização
- Ionização em Água: O hidróxido de cálcio é uma base moderadamente forte e ioniza-se parcialmente em água. Ca(OH)2↔Ca2+ + 2OH−Em solução aquosa, o Ca(OH)₂ se dissocia em íons cálcio (Ca²⁺) e íons hidroxila (OH⁻), mas não é completamente solúvel.
Aplicações
- Indústria: Usado na fabricação de cimento e cal.
- Agricultura: Utilizado para corrigir a acidez do solo (calagem).
- Tratamento de Água: Neutralização de ácidos e ajuste de pH.
4. Hidróxido de Magnésio (Mg(OH)₂)
Ionização
- Ionização em Água: O hidróxido de magnésio é uma base fraca e ioniza-se parcialmente em água. Mg(OH)2↔ Mg2+ + 2OH− Em solução aquosa, o Mg(OH)₂ se dissocia em íons magnésio (Mg²⁺) e íons hidroxila (OH⁻), mas é pouco solúvel.
Aplicações
- Medicina: Utilizado como antiácido em medicamentos para alívio de azia e indigestão.
- Tratamento de Água: Neutralização de ácidos e como floculante em processos de purificação de água.
5. Amônia (NH₃)
Ionização
- Ionização em Água: A amônia é uma base fraca e ioniza-se parcialmente em água. NH3+H2O↔NH4+ + OH− Em solução aquosa, a amônia se dissocia parcialmente em íons amônio (NH₄⁺) e íons hidroxila (OH⁻).
Aplicações
- Indústria: Usada na produção de fertilizantes, explosivos e produtos de limpeza.
- Agricultura: Fertilizantes contendo amônia são amplamente utilizados para fornecer nitrogênio às plantas.
- Tratamento de Água: Ajuste de pH e remoção de impurezas.
6. Hidróxido de Alumínio (Al(OH)₃)
Ionização
- Ionização em Água: O hidróxido de alumínio é uma base fraca e ioniza-se parcialmente em água. Al(OH)3+H2O↔Al3+ + 3OH− Em solução aquosa, o Al(OH)₃ se dissocia em íons alumínio (Al³⁺) e íons hidroxila (OH⁻), mas tem baixa solubilidade.
Aplicações
- Medicina: Usado em antiácidos e tratamentos para úlceras gástricas.
- Tratamento de Água: Utilizado como coagulante para remover partículas e impurezas.
3. Sais

Propriedades
- Sabor: Geralmente salgado (como o cloreto de sódio, NaCl).
- Condutividade: São bons condutores de eletricidade quando dissolvidos em água.
- Solubilidade: Muitos sais são solúveis em água, mas há exceções.
Como se Apresentam
- Forma: Normalmente sólidos cristalinos. Por exemplo, o cloreto de sódio é um sólido branco.
Ionização
- Dissociação: Em solução aquosa, os sais se dissociam em seus íons constituintes. Por exemplo, NaCl se dissocia em Na⁺ e Cl⁻.
Exemplos
- Cloreto de sódio (NaCl): Sal de cozinha, usado para temperar alimentos.
- Sulfato de cobre (CuSO₄): Utilizado em fertilizantes e como fungicida.
- Nitrato de potássio (KNO₃): Usado em fertilizantes e pólvora.
Aplicações
- Culinária: Temperar e conservar alimentos.
- Agricultura: Fertilizantes e aditivos para melhorar a qualidade do solo.
- Indústria: Em processos químicos e como matéria-prima.
Principais Sais Inorgânicos
1. Cloreto de Sódio (NaCl)
Ionização
- Ionização em Água: O cloreto de sódio é um sal que ioniza-se completamente em água.
- NaCl→Na+ + Cl− Em solução aquosa, o NaCl se dissocia totalmente em íons sódio (Na⁺) e íons cloreto (Cl⁻).
Aplicações
- Culinária: Usado como tempero e conservante em alimentos.
- Indústria: Produção de produtos químicos, como soda cáustica e cloro.
- Tratamento de Água: Utilizado em processos de dessalinização e tratamento de água.
2. Sulfato de Cálcio (CaSO₄)
Ionização
- Ionização em Água: O sulfato de cálcio é um sal que se dissocia parcialmente em água.
- CaSO4↔Ca2+ + SO42− Em solução aquosa, o CaSO₄ se dissocia em íons cálcio (Ca²⁺) e íons sulfato (SO₄²⁻), mas sua solubilidade é limitada.
Aplicações
- Construção: Usado na fabricação de gesso para construção e na produção de drywall.
- Agricultura: Utilizado para corrigir a acidez do solo e fornecer cálcio.
- Medicina: Aplicado em gessos ortopédicos para imobilização de fraturas.
3. Nitrato de Potássio (KNO₃)
Ionização
- Ionização em Água: O nitrato de potássio é um sal que se dissocia completamente em água.
- KNO3→K+ + NO3− Em solução aquosa, o KNO₃ se dissocia totalmente em íons potássio (K⁺) e íons nitrato (NO₃⁻).
Aplicações
- Agricultura: Usado como fertilizante para fornecer potássio e nitrogênio às plantas.
- Indústria: Produção de pólvora e explosivos.
- Tratamento de Água: Remoção de impurezas e ajuste de pH.
4. Cloreto de Potássio (KCl)
Ionização
- Ionização em Água: O cloreto de potássio é um sal que se dissocia completamente em água.
- KCl→K+ + Cl− Em solução aquosa, o KCl se dissocia totalmente em íons potássio (K⁺) e íons cloreto (Cl⁻).
Aplicações
- Agricultura: Utilizado como fertilizante para fornecer potássio às plantas.
- Medicina: Usado para tratar deficiências de potássio no organismo.
- Indústria: Produção de produtos químicos e aditivos alimentares.
5. Carbonato de Cálcio (CaCO₃)
Ionização
- Ionização em Água: O carbonato de cálcio é pouco solúvel em água e dissocia-se parcialmente. CaCO3↔Ca²⁺+ CO₃²⁻
- Em solução aquosa, o CaCO₃ se dissocia em íons cálcio (Ca²⁺) e íons carbonato (CO₃²⁻), mas a solubilidade é limitada.
Aplicações
- Construção: Usado na fabricação de cimento e cal.
- Medicina: Suplemento de cálcio para ossos e dentes.
- Agricultura: Correção da acidez do solo e como suplemento mineral.
6. Sulfato de Cobre (CuSO₄)
Ionização
- Ionização em Água: O sulfato de cobre é um sal que se dissocia completamente em água. CuSO4→Cu²⁺+SO₄²⁻
- Em solução aquosa, o CuSO₄ se dissocia totalmente em íons cobre (Cu²⁺) e íons sulfato (SO₄²⁻).
Aplicações
- Agricultura: Utilizado como fungicida e algicida.
- Indústria: Usado em processos de galvanoplastia e na fabricação de corantes.
- Laboratórios: Reagente em várias análises químicas.
7. Cloreto de Amônio (NH₄Cl)
Ionização
- Ionização em Água: O cloreto de amônio é um sal que se dissocia completamente em água.
- NH4Cl→NH4+ + Cl−
- Em solução aquosa, o NH₄Cl se dissocia totalmente em íons amônio (NH₄⁺) e íons cloreto (Cl⁻).
Aplicações
-
- Medicina: Usado como expectorante em medicamentos para tratar tosse.
- Limpeza: Ingrediente em produtos de limpeza e desinfetantes.
- Indústria: Usado em fertilizantes e como reagente em laboratórios.
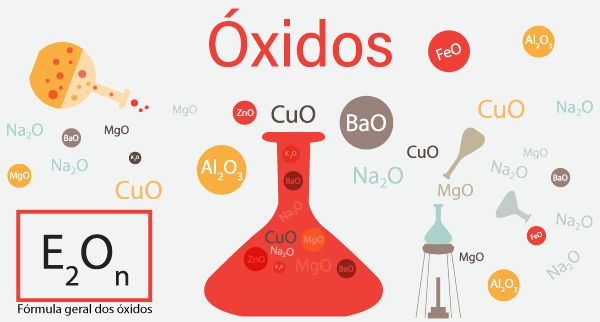
4. Óxidos
Propriedades
- Estado físico: Pode ser sólido, líquido ou gasoso, dependendo do óxido.
- Reatividade: Muitos óxidos reagem com água para formar ácidos ou bases. Por exemplo, óxidos ácidos reagem com água para formar ácidos, enquanto óxidos básicos reagem com água para formar bases.
Como se Apresentam
- Forma: Pode ser sólido (como óxido de ferro), líquido (como óxido de mercúrio) ou gasoso (como dióxido de carbono).
Ionização
- Óxidos ácidos: Reagem com água para formar ácidos (por exemplo, SO₂ + H₂O → H₂SO₃).
- Óxidos básicos: Reagem com água para formar bases (por exemplo, Na₂O + H₂O → 2 NaOH).
Exemplos
- Óxido de ferro (Fe₂O₃): Presente na ferrugem e utilizado em pigmentos.
- Dióxido de carbono (CO₂): Presente na respiração e na fotossíntese; usado em refrigerantes.
- Óxido de cálcio (CaO): Usado em construção e tratamento de água.
Aplicações
- Indústria: Produção de cimento e vidros.
- Ambiente: Regulação do CO₂ na atmosfera e absorção de poluentes.
- Saúde: Tratamento de água e controle de qualidade.
Principais Óxidos Inorgânicos
1. Dióxido de Carbono (CO₂)
Ionização
- Ionização em Água: O dióxido de carbono reage com água para formar ácido carbônico, que se ioniza parcialmente. CO2+H2O↔H2CO3.
- Em solução aquosa, o CO₂ forma ácido carbônico (H₂CO₃), que se dissocia em íons hidrogênio (H⁺) e íons bicarbonato (HCO₃⁻), e este, por sua vez, pode se dissociar em íons bicarbonato e carbonato (CO₃²⁻).
Aplicações
- Ambiente: Regulação do pH nos oceanos e atmosfera; é um gás de efeito estufa.
- Indústria: Utilizado na produção de refrigerantes e extintores de incêndio; também em processos de fermentação.
- Medicina: Utilizado em terapias de inalação e para tratar problemas respiratórios.
2. Monóxido de Carbono (CO)
Ionização
- Ionização em Água: O monóxido de carbono não se ioniza em água; é um gás que não forma ácido ou base em solução aquosa.
Aplicações
- Indústria: Usado na produção de ferro e aço; como agente redutor em processos químicos.
- Medicina: Em doses controladas, é estudado para tratamentos terapêuticos devido a suas propriedades vasodilatadoras.
3. Dióxido de Nitrogênio (NO₂)
Ionização
- Ionização em Água: O dióxido de nitrogênio reage com água para formar ácido nitroso e ácido nítrico, que se ionizam. 2 NO2+H2O→HNO2+HNO3
Aplicações
- Ambiente: Contribui para a formação de chuva ácida e poluição do ar.
- Indústria: Usado na fabricação de ácido nítrico e como reagente em processos de nitrificação.
4. Óxido de Nitrogênio (NO)
Ionização
- Ionização em Água: O óxido de nitrogênio não se ioniza em água, mas reage com oxigênio para formar dióxido de nitrogênio (NO₂).
Aplicações
- Indústria: Utilizado na produção de ácido nítrico e como intermediário em sínteses químicas.
- Medicina: Estudos sobre o uso de óxido nítrico para tratar condições relacionadas a vasos sanguíneos.
5. Óxido de Cálcio (CaO)
Ionização
- Ionização em Água: O óxido de cálcio reage com água para formar hidróxido de cálcio, que se dissocia completamente. CaO+H2O→Ca(OH)2
- Construção: Usado na fabricação de cimento e cal para construção.
- Agricultura: Utilizado para corrigir a acidez do solo (calagem).
- Indústria: Usado na produção de vidro e em processos de tratamento de água.
6. Óxido de Magnésio (MgO)
Ionização
- Ionização em Água: O óxido de magnésio reage com água para formar hidróxido de magnésio, que se dissocia parcialmente. MgO+H2O→Mg(OH)2
Aplicações
- Medicina: Usado como antiácido e laxante.
- Construção: Utilizado em materiais de construção e refratários.
- Agricultura: Suplemento de magnésio para o solo.
7. Óxido de Ferro (Fe₂O₃ e FeO)
Ionização
- Ionização em Água: Os óxidos de ferro não se ionizam em água, mas reagem com ácidos e bases.
Aplicações
- Indústria: Utilizados na produção de pigmentos e na fabricação de aço.
- Construção: Componentes em tintas e revestimentos.
8. Óxido de Alumínio (Al₂O₃)
Ionização
- Ionização em Água: O óxido de alumínio reage com ácidos e bases, formando sais e água.
Indústria: Usado na produção de alumínio e em abrasivos. - Construção: Utilizado em materiais de construção e cerâmicas.