Depois das funções inorgânicas vem esse assunto: como as reações se processam?
Como as várias substâncias formadas se unem?
Como Ocorrem as Reações Inorgânicas
Reações inorgânicas são transformações químicas que envolvem substâncias que não contêm carbono hidrogênio em sua composição (embora algumas exceções possam ocorrer). Estas reações acontecem quando os átomos dos reagentes se reorganizam para formar novos produtos.
Exemplo Simples:
Considere a reação entre o sódio (Na) e a água (H₂O):
2Na+2H2O
Aqui, o sódio (Na) reage com a água (H₂O) para formar hidróxido de sódio (NaOH) e hidrogênio gasoso (H₂).
Passos para entender como essas reações ocorrem:
- Quebra de Ligações: As ligações entre os átomos nos reagentes são rompidas.
- Rearranjo dos Átomos: Os átomos se rearranjam para formar novos produtos.
- Formação de Novas Ligações: Novas ligações são formadas para criar as substâncias finais.
2. Funções das Reações Inorgânicas
As reações inorgânicas têm várias funções importantes, incluindo:
- Síntese de Novos Compostos: Criam novos materiais e produtos químicos, como fertilizantes e medicamentos.
- Processos Naturais: São fundamentais em processos naturais, como a fotossíntese e a respiração celular.
- Indústria e Tecnologia: Usadas em processos industriais, como na fabricação de metais e no tratamento de águas.
-

reações químicas inorgânicas- imagem: Brasil Escola
3. Tipos de Reações Inorgânicas
Existem vários tipos de reações inorgânicas, e aqui estão algumas das principais:
- Reação de Síntese ou Adição:
- Exemplo: A+B→AB
- Descrição: Duas ou mais substâncias se combinam para formar um único produto.
- Exemplo: 2H2+O2→2H2O2
-

Reação entre o gás cloreto de hidrogênio e o gás amônia, formando o sal cloreto de amônio (vapor branco) imagem: Manual da Química
- Reação de Decomposição:
- Exemplo: AB→A+B
- Descrição: Um composto se decompõe em dois ou mais produtos.
- Exemplo: 2HgO→2Hg+O2
-

O bio-óleo, ou alcatrão pirolítico, é resultado de uma reação de decomposição por fogo, ou seja, por pirólise – imagem: https://www.preparaenem.com/quimica
- Reação de Substituição Simples:
- Exemplo: A+BC→AC+B
- Descrição: Um elemento substitui outro em um composto.
- Exemplo: Zn+2HCl→ZnCl2+H2
-

Zinco em ácido clorídrico – uma reação de simples troca ou oxirredução imagem: https://www.manualdaquimica.com
- Reação de Substituição Dupla:
- Exemplo: AB+CD→
- Descrição: Os íons em dois compostos trocam de lugar.
- Exemplo: Na2SO4+BaCl2→BaSO4+2NaCl
-

A reação de dupla troca entre o nitrato de chumbo e o iodeto de sódio forma um precipitado amarelo (iodeto de chumbo) Pb(NO3)2(aq) + NaI(aq) → PbI2(s) + 2 NaNO3(aq) imagem: Manual da Química
- Reação de Combustão:
- Exemplo: CxHy+O2→CO2+H2O
- Descrição: Um composto reage com oxigênio para formar dióxido de carbono e água.
- Exemplo: CH4+2O2→CO2+2H2O
-

reação de combustão- imagem: Brasil Escola
RESUMO:
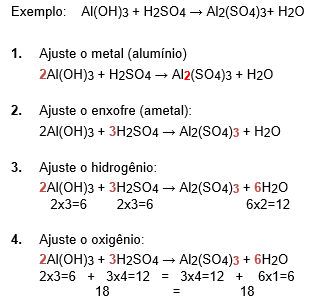
4. Balanceamento de Equações Químicas
Para balancear uma equação química, você precisa garantir que o número de átomos de cada elemento seja o mesmo nos reagentes e nos produtos. Aqui está um passo a passo simples:
- Escreva a Equação Não Balanceada: Coloque todos os reagentes e produtos.
- Conte os Átomos de Cada Elemento: Faça uma contagem dos átomos de cada elemento em ambos os lados da equação.
- Ajuste os Coeficientes: Coloque números na frente dos compostos (coeficientes) para equilibrar os átomos de cada elemento. Comece com os elementos que aparecem em menos compostos.
- Verifique o Balanceamento: Assegure-se de que o número de átomos de cada elemento seja igual em ambos os lados da equação.
Exemplo Prático:
Equação não balanceada: H2+O2→H2O
Contagem dos átomos:
-
- Lado dos reagentes: 2 H e 2 O
- Lado dos produtos: 2 H e 1 O
- Ajuste os coeficientes: Coloque um 2 na frente do H2O
- Verifique:
- Lado dos reagentes: 2 H e 2 O
- Lado dos produtos: 4 H e 2 O
- Ajuste novamente: 2H2+O2→2H2O
Verifique que a equação está balanceada.
Outro exemplo: