CURVAS DE SOLUBILIDADE
O que é uma Curva de Solubilidade?
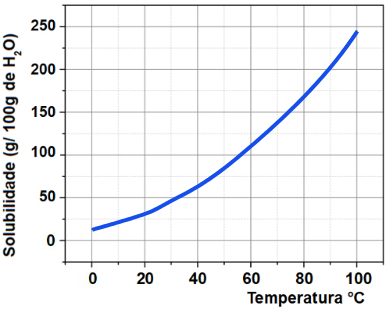
A curva de solubilidade é um gráfico que mostra como a solubilidade de uma substância (geralmente um sólido) em um solvente (como água) varia com a temperatura. Em outras palavras, ela indica a quantidade máxima de soluto que pode se dissolver em uma quantidade fixa de solvente a diferentes temperaturas.
Componentes da Curva
- Eixo X (Horizontal): Representa a temperatura, geralmente em graus Celsius (°C).
- Eixo Y (Vertical): Representa a solubilidade do soluto, normalmente em gramas de soluto por 100 mL de solvente.
Como Ler a Curva
- Ponto no gráfico: Cada ponto na curva indica a solubilidade do soluto a uma temperatura específica. Por exemplo, se a curva mostra que a 25 °C, a solubilidade de um sal é de 30 g/100 mL, isso significa que, a essa temperatura, 30 gramas do sal podem se dissolver em 100 mL de água.
- Abaixo da curva: Se você tiver menos soluto dissolvido do que o indicado pela curva, a solução é in saturada (ou seja, ainda pode dissolver mais soluto).
- Sobre a curva: Se houver mais soluto do que a curva indica, a solução é supersaturada, e o excesso não se dissolve.
-
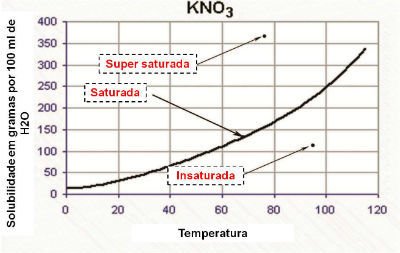
Curva de solubilidade de KNO3 / 100 ml de água – veja os pontos de saturada, insaturada e supersaturada imagem: Toda Matéria
Importância da Curva de Solubilidade
- Previsão da solubilidade: Ajuda a prever se uma substância vai se dissolver ou não em um determinado solvente a uma dada temperatura.
- Reações químicas: Em reações químicas, saber a solubilidade pode influenciar o resultado da reação.
- Aplicações práticas: Utilizada em diversas áreas, como farmácia, meio ambiente e processos industriais.
Fatores que Influenciam a Solubilidade
- Temperatura: Na maioria dos casos, a solubilidade de sólidos em líquidos aumenta com o aumento da temperatura.
- Pressão: Para gases, a solubilidade aumenta com o aumento da pressão (Lei de Henry).
- Natureza do soluto e solvente: A polaridade e a estrutura química de ambos influenciam a solubilidade (o ditado “semelhante dissolve semelhante”).
Exemplos
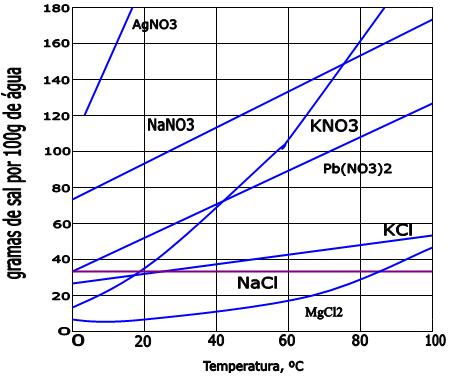
- Cloreto de sódio (NaCl): A solubilidade aumenta com a temperatura, o que é comum para muitos sais.

- Gases em geral: Em água, sua solubilidade diminui com o aumento da temperatura.
EXERCÍCIOS COM CURVAS DE SOLUBILIDADE:
1-O gráfico abaixo indica as curvas de solubilidade de quatro diferentes sais:
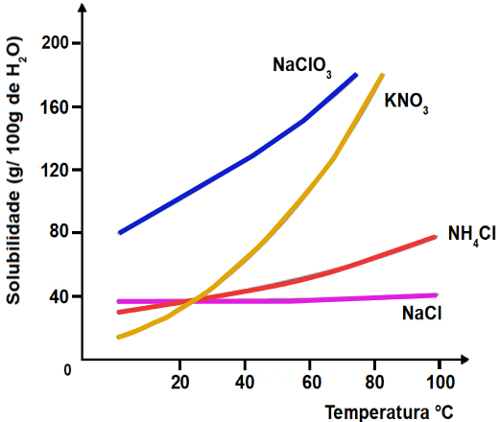
Qual destes sais apresenta maior solubilidade a 40oC?
a) NaClO3
b) KNO3
c) NH4Cl
d) NaCl
Resolução:
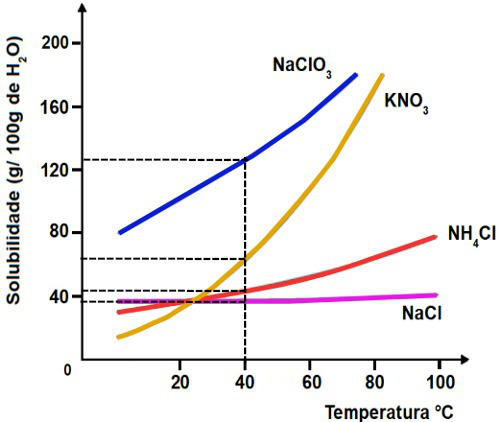
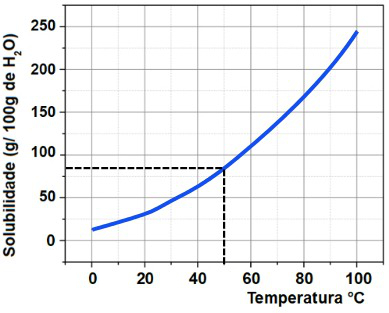
2-A curva de solubilidade da substância KNO3 dissolvida em 100 g de água em função da temperatura é mostrada abaixo.
Se tivermos 40g de água a 50o C, qual será a massa de KNO3 dissolvida?
a) 28 g
b) 56 g
c) 33,6 g
d) 45 g
Resolução:
Para determinar a massa em gramas de KNO3 que pode ser dissolvida em 100 gramas de H2O, devemos, inicialmente, tracejar uma linha a partir da temperatura 50o C no eixo x até atingir a curva. Em seguida, devemos tracejar uma linha no eixo y até a solubilidade presente.
Como a marca zero da solubilidade nesse gráfico é dada mais acima, a massa de soluto dissolvida por 100 gramas de H2O é de aproximadamente 84 g.
Por fim, montamos uma regra de três simples para calcular a massa de KNO3 que pode ser dissolvida por 40 gramas de H2O:
100g de H2O————- 84g de KNO3
40g de H2O———— x
100.x = 40.84
100x = 3360
x = 3360
100
x = 33,6g de KNO3 – ( https://exercicios.brasilescola.uol.com.br)
3-Considere o gráfico:

Curvas de solubilidade de KNO3 e de Na2SO4 em 100 g de água
Indique a alternativa correta:
a) No intervalo de temperatura de 0 ºC a 30 ºC, há diminuição da solubilidade do nitrato de potássio.
b) A solubilidade do sulfato de sódio diminui a partir de 20 ºC.
c) Na temperatura de 40 ºC, o nitrato de potássio é mais solúvel que o sulfato de sódio.
d) Na temperatura de 60 ºC, o sulfato de sódio é mais solúvel que o nitrato de potássio.
e) No intervalo de temperatura de 30 ºC a 100 ºC, há diminuição da solubilidade do sulfato de sódio.
Alternativa “e”.
a) Falsa. No intervalo de temperatura de 0 ºC a 30 ºC, a solubilidade do nitrato de potássio continua crescendo, bem como em todas as temperaturas apresentadas.
b) Falsa. A solubilidade do sulfato de sódio diminui somente a partir de 30 ºC, e não de 20ºC.
c) Falsa. Na temperatura de 40 ºC, a solubilidade do nitrato de potássio é igual à do sulfato de sódio.
d) Falsa. Na temperatura de 60 ºC, o sulfato de sódio é menos solúvel que o nitrato de potássio. O sulfato de sódio só será mais solúvel que o nitrato de potássio no intervalo de 20º C a 40ºC.
e) Verdadeira. No intervalo de temperatura de 30 ºC a 100 ºC, há diminuição da solubilidade do sulfato de sódio.
4-Com base no gráfico a seguir, indique como está uma solução situada no ponto (20,35):

Gráfico de curva de solubilidade em exercício
a) insaturada.
b) saturada.
c) saturada com corpo de fundo.
d) supersaturada.
e) supersaturada com corpo de fundo.
Alternativa “c”.
No (20,35)—- lembre que o primeiro número se refere ao eixo X e o segundo número ao eixo Y —-, foram dissolvidos 35 g do soluto em 100 g de água a 20 ºC. Na curva de solubilidade, vemos que, nessa temperatura, o coeficiente de solubilidade é de cerca de 15 g/100 g de água. Então, temos que 15 g dissolvem-se na água, formando uma solução saturada, e 20 g formam um corpo de chão( quantidade que vai para o fundo do recipiente porque não conseguiu se dissolver) porque não se dissolvem. ( https://exercicios.mundoeducacao.uol.com.br/)
VÍDEO EXPLICATIVO SOBRE SOLUBILIDADE