CINÉTICA QUÍMICA
A cinética química é o ramo da química que estuda a velocidade das reações químicas e os fatores que influenciam essa velocidade. Os princípios fundamentais dessa área incluem a compreensão dos fatores que afetam as taxas de reação, a relação entre a velocidade de uma reação e as concentrações dos reagentes, e como a teoria das colisões e a teoria do estado de transição explicam o comportamento das partículas reativas.
Aqui estão os principais princípios da cinética química:
1. Teoria das Colisões
A teoria das colisões é uma das bases da cinética química. Ela sugere que, para uma reação química ocorrer, as partículas (moléculas ou átomos) dos reagentes devem colidir entre si. No entanto, não todas as colisões resultam em uma reação. As colisões devem:
- Ter energia suficiente (energia de ativação) para superar a barreira energética da reação.
- Ser orientadas corretamente, ou seja, as moléculas devem colidir de maneira que favoreçam a formação dos produtos.

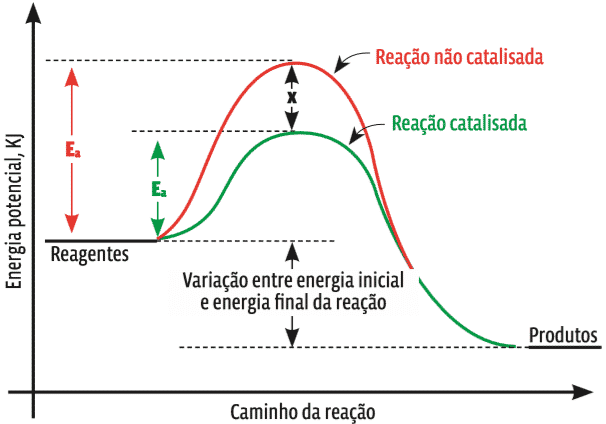
2. Energia de Ativação (Ea)
A energia de ativação é a energia mínima necessária para que uma reação química ocorra. Essa energia é usada para romper as ligações dos reagentes e formar os produtos. Quanto maior a energia de ativação, mais difícil será a reação, e isso geralmente resulta em uma menor velocidade de reação. O aumento da temperatura ou o uso de catalisadores pode diminuir a energia de ativação, acelerando a reação.
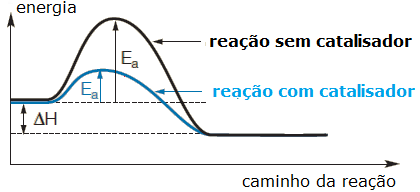
CATALISADORES: Um catalisador é uma substância que pode ser adicionada a uma reação para aumentar a sua velocidade sem ser consumida durante o processo. Os catalisadores em geral aceleram uma reação pela diminuição da sua energia de ativação ou mudança do seu mecanismo.( Khan Academy)
Importante saber que o catalisador não faz parte dos produtos e sai da mesma forma que entrou.
3. Velocidade de Reação
A velocidade de uma reação química é a taxa com que os reagentes são consumidos ou os produtos são formados. A velocidade de reação pode depender de vários fatores:
- Concentração dos reagentes: Em geral, a velocidade de reação aumenta à medida que a concentração dos reagentes aumenta, pois as partículas colidem com maior frequência.
- Temperatura: Um aumento na temperatura geralmente aumenta a velocidade de reação, pois as partículas ganham mais energia cinética e colidem mais vigorosamente.
- Catalisadores: Catalisadores são substâncias que aumentam a velocidade de uma reação sem serem consumidos no processo. Eles fazem isso proporcionando um caminho alternativo para a reação com uma energia de ativação mais baixa.
- Considere a reação genérica a seguir, em que os coeficientes são as letras minúsculas e os reagentes e produtos estão representados pelas letras maiúsculas:
a A + b B → c C + d D
A velocidade média dessa reação será dada dividindo-se a velocidade média de reação de qualquer uma das substâncias reagentes ou a velocidade média de formação de qualquer um dos produtos pelo seu respectivo coeficiente na equação química. Isto é dado por:
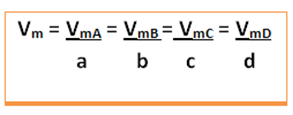
Por exemplo, considere a reação de decomposição da água oxigenada:
2 H2O2(aq) → 2 H2O(l) + 1 O2 (g)
Digamos que em 1 minuto se formaram 0,3 mol/L de H2O e 0,15 mol/L de O2, enquanto se decompôs 0,3 mol/L de H2O2, ou seja, temos que as velocidades médias de decomposição e de formação dessas substâncias da reação são de:
VmH2O2 = 0,3 mol/L . min
VmH2O = 0,3 mol/L . min
VmO2 = 0,15 mol/L . min
- A velocidade média da reação global será encontrada ao pegar um desses valores e dividi-lo pelo respectivo coeficiente na equação:
Vm/2 = VmH2O2/2 = 0,3 mol/L . min = 0,15 mol/L . min
Vm/2 = VmH2O/2 = 0,3 mol/L . min = 0,15 mol/L . min
Vm/1 = VmO2/1 = 0,15 mol/L . min = 0,15 mol/L . min - As velocidades, para serem calculadas, devem ser divididas pelo número que antecede a fórmula ( o número de mol)
- OUTRA FORMA DE CÁLCULO DE VELOCIDADE

Por exemplo, considere a seguinte reação de decomposição do gás ozônio (O3(g)) em gás oxigênio (O2(g)):
2 O3(g) → 3 O2(g)
Digamos que num balão havia 10 mol de gás ozônio, mas após 1 minuto, restaram apenas 4 mol; isto significa que 6 mol de ozônio transformaram-se em gás oxigênio. Assim, temos:
2 O3(g) → 3 O2(g)
t = 0 min 2 mol/L 0 mol/L
gastos formados
6 mol/L 9 mol/L
t = 1 min 4 mol/L 9 mol/L
Veja que como a proporção da reação é de 2:3, então, se foram gastos 6 mol de O3, foram formados 9 mol de O2. Assim, após 1 minuto, temos as seguintes velocidades médias:
“Vm = – ∆ [O3] / ∆t
Vm = – ([O3final – O3inicial])/ tfinal – tinicial
Vm = – ([4 – 10])/ 1– 0
Vm = 6 mol/L . min→ Durante 1 minuto, 6 mol de ozônio reagiram em cada litro do sistema.
Vm = ∆ [O2]/ ∆t
Vm = ([O2final – O2inicial])/ tfinal – tinicial
Vm = ([9 – 0])/ 1– 0
Vm = 9 mol/L . min→ Durante 1 minuto, 9 mol de oxigênio foram formados em cada litro do sistema.
Isso nos mostra que podemos calcular a velocidade média em função dos reagentes ou em função dos produtos.
Agora, se quisermos calcular a velocidade média dessa reação global, basta fazer como mostramos no início: dividir cada uma dessas velocidades pelos seus respectivos coeficientes na equação química:
Vm = VmO3/2 = 6 mol/L . min /2 = 3 mol/L . min
Vm = VmO2/3 = 9 mol/L . min/3 = 3 mol/L . min
Vm = VmO3/2 = VmO2 /3
Pesquisa: https://brasilescola.uol.com.br/quimica
EXERCÍCIOS:
1-(UECE) Seja a reação: X → Y + Z. A variação na concentração de X em função do tempo é:
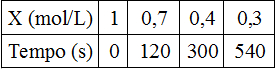
Tabela em exercício sobre velocidade média de uma reação química
A velocidade média da reação no intervalo de 2 a 5 minutos é:
a) 0,3 mol/L.min.
b) 0,1 mol/L.min.
c) 0,5 mol/L.min.
d) 1,0 mol/L.min.
e) 1,5 mol/L.min.
Resolução:
Tendo em vista que 2 minutos = 120 segundos e que 5 minutos = 300 segundos, temos:
Vm = ∆[X]
∆t
Vm = [Xfinal – Xinicial]
tfinal – tinicial
Vm = [0,4-0,7] mol/L
(5-2) min
Vm = [-0,3]mol/L
3 min
Vm = 0,1 mol/L.min.
2-Sobre os fatores que influenciam a velocidade de uma reação química é INCORRETO afirmar que:
a) Quanto maior a concentração dos reagentes, maior a velocidade da reação.
b) Quanto maior a superfície de contato, maior a velocidade da reação.
c) Quanto maior a pressão, maior a velocidade da reação.
d) Quanto maior a temperatura, maior a velocidade da reação.
e) A presença de um catalisador mantém constante a velocidade da reação.
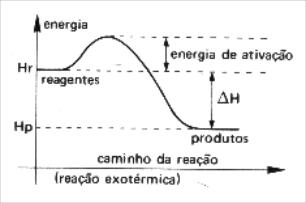
4-
(Mackenzie-SP)

O gráfico acima representa a reação:
X + Y → Z
Os valores do ΔH e da energia de ativação, em kJ/mol, são, respectivamente,
a) + 50 e 20.
b) + 15 e 45.
c) + 30 e 20.
d) + 5 e 20.
e) + 25 e 55.
Resolução:
Letra b). Para calcular o valor do ΔH, basta utilizar a expressão:
ΔH = Hp– Hr
ΔH = 20 – 5
ΔH = 15 KJ
Hp (entalpia dos produtos) e Hr (entalpia dos reagentes)
Já a energia de ativação sempre parte dos reagentes (5 KJ) em direção ao complexo (50 KJ). Para calculá-la, basta realizar a diferença entre o complexo e os reagentes:
50-5 = 45 KJ
Exercícios pesquisados em: https://exercicios.mundoeducacao.uol.com.br