FUNÇÃO CETONA
A função cetona é um dos grupos funcionais mais importantes na química orgânica. Vamos explorar suas características, nomenclatura, principais cetonas, utilizações, benefícios, malefícios, reações importantes e onde são encontradas.
Características das Cetonas
- Fórmula geral: R-CO-R’, onde R e R’ são radicais orgânicos (alquila ou arila) e CO é o grupo carbonila (C=O).
-
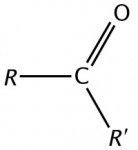
cetona- estrutura – R e R’ são radicais de carbono. Imagem: Toda Matéria - Grupo funcional: Carbonila (C=O) ligada a dois átomos de carbono.
- Polaridade: A presença da carbonila torna as cetonas polares, o que influencia suas propriedades físicas e químicas.
- Pontos de fusão e ebulição: São mais altos que os de hidrocarbonetos de massa molecular semelhante, devido às interações dipolo-dipolo.
- Solubilidade: São solúveis em solventes orgânicos e, em menor grau, em água (para cetonas menores, como a acetona).
Nomenclatura
A nomenclatura das cetonas segue as regras da IUPAC:
- Identifica-se a cadeia principal mais longa que contém o grupo carbonila.
- A numeração começa pela extremidade mais próxima do grupo carbonila.
- O sufixo “-ona” é usado para indicar a presença da cetona.
- Se houver mais de um grupo carbonila, usa-se os prefixos “diona”, “triona”, etc.
-
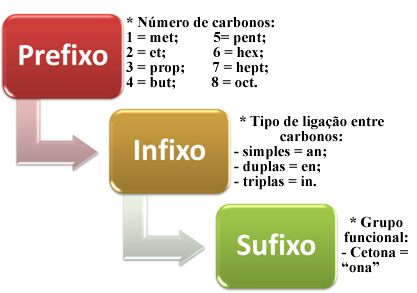
Nomenclatura de cetonas- Imagem: Manual da Química
Exemplos:
- Propanona (acetona): CH₃-CO-CH₃
-
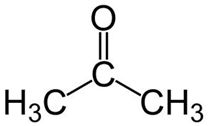
propanona – Imagem: InfoEscola - Butan-2-ona: CH₃-CH₂-CO-CH₃
-
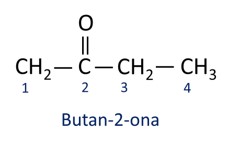
A numeração da cadeia carbônica obedece à função : começar pelo carbono mais próximo da função. Imagem Brasil Escola - Pentan-2-ona: CH₃-CH₂-CH₂-CO-CH₃
-
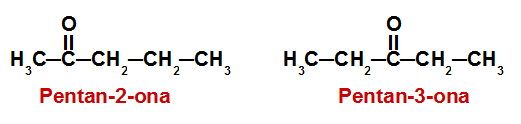
duas cetonas que são diferentes porque tem a função em locais diferentes. Imagem; Manual da Química
Principais Cetonas
- Acetona (Propanona):
- Fórmula: CH₃-CO-CH₃
-

propanona – usada como removedor de esmaltes e na produção de fibras plásticas- Imagem: Manual da Química - Usada como solvente e na produção de plásticos e fibras.
- Butanona (Metiletilcetona):
- Fórmula: CH₃-CH₂-CO-CH₃
- Usada em vernizes e adesivos.
- Cicloexanona:
- Fórmula: C₆H₁₀O
- Usada na produção de náilon.
Utilização das Cetonas
- Solventes: A acetona é amplamente usada como solvente em indústrias químicas e de cosméticos.
- Produção de polímeros: Cetonas como a cicloexanona são usadas na síntese de náilon e outros plásticos.
- Farmacêutica: Algumas cetonas são intermediárias na síntese de medicamentos.
- Cosméticos: Presentes em removedores de esmalte e fragrâncias.
- Cadeias pequenas (até dez átomos e carbono) levam a cetonas no estado líquido, menos densas que a água, de cheiro agradável e que, em geral, são parcialmente solúveis – exceção para a propanona que é totalmente solúvel. Cadeias com mais de dez carbonos levam a cetonas sólidas e insolúveis em água.
- Industrialmente, muitos dos óleos essenciais extraídos de flores e frutos e usados na produção de perfumes são compostos cetônicos. Elas também são usadas na extração de gorduras de sementes como o girassol e o amendoim. Cetonas também podem ser usadas para extrair cocaína das folhas de coca, o que torna seu uso restrito e fiscalizado por órgãos da polícia federal.( https://www.infoescola.com/)
- Acetofenona: é a cetona aromática mais simples sendo incolor e de alta viscosidade. É utilizada como precursor na preparação de diversas resinas e fragrâncias (principalmente como aroma artificial de amêndoa, cereja, jasmim e morango), sendo também o precursor acadêmico clássico para o estireno.
-
Acetofenona= imagem: Wikipédia
Benefícios
- Eficiência como solventes: Cetonas como a acetona são eficazes na dissolução de gorduras, resinas e outros compostos orgânicos.
- Versatilidade industrial: Usadas em diversas indústrias, desde a produção de plásticos até a fabricação de medicamentos.
- Baixa toxicidade (em baixas concentrações): A acetona, por exemplo, é relativamente segura quando usada corretamente.
Malefícios
- Toxicidade em altas concentrações: A inalação ou ingestão de grandes quantidades de cetonas pode causar tonturas, náuseas e danos ao sistema nervoso.
- Inflamabilidade: Cetonas como a acetona são altamente inflamáveis, representando riscos de incêndio.
- Impacto ambiental: Algumas cetonas podem contribuir para a poluição do ar e da água se não forem descartadas corretamente.
Reações Importantes
- Redução de cetonas:
- Cetonas podem ser reduzidas a álcoois secundários usando agentes redutores como o hidreto de lítio e alumínio (LiAlH₄).
- Exemplo: CH₃-CO-CH₃ + H₂ → CH₃-CH(OH)-CH₃ (isopropanol).
- Oxidação:
- Cetonas são resistentes à oxidação, mas sob condições drásticas podem sofrer clivagem oxidativa, formando ácidos carboxílicos.
- Reação com reagente de Grignard:
- Cetonas reagem com reagentes de Grignard (R-Mg-X) para formar álcoois terciários.
- Exemplo: CH₃-CO-CH₃ + CH₃MgBr → (CH₃)₃C-OH.
- Formação de cianoidrinas:
- Cetonas reagem com cianeto de hidrogênio (HCN) para formar cianoidrinas.
- Exemplo: CH₃-CO-CH₃ + HCN → CH₃-C(OH)(CN)-CH₃.
Onde é Encontrada
- Natureza: Algumas cetonas são encontradas em óleos essenciais de plantas e em feromônios de insetos.
- Metabolismo humano: A acetona é produzida no corpo durante o metabolismo de gorduras (cetose).
- Indústria: Presente em solventes, produtos de limpeza, plásticos e medicamentos.
Em resumo, as cetonas são compostos versáteis com ampla aplicação na indústria e na natureza, mas seu uso requer cuidados devido à sua toxicidade e inflamabilidade.
EXERCÍCIOS :
1-
Dê o nome das seguintes cetonas:
a)
.exercicios.jpg)
b)
.exercicios.jpg)
c)
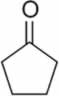
d)
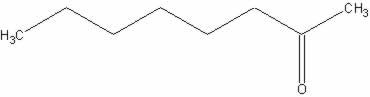
e)
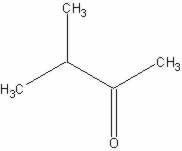
Resposta:
a) cicloexanona
b) pentan-3-ona
c) ciclopentanona
d) octan-2-ona
e) 3-metil-butan-2-ona
2-
A cetona é um composto carbonílico com 3 átomos de carbono e cadeia saturada. Sua fórmula molecular é:
a) C3H6O
b) C3H7O
c) C3H8O
d) C3H8O2
e) C3H8O3
Resposta:
A cetona, também conhecida como propanona possui fórmula molecular C3H6O
DeepSeek
Imagem Inicial=Metal Química

