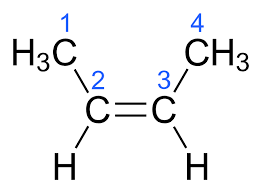
Isomeria Geométrica (Cis-Trans / E-Z)
1. Conceito
A isomeria geométrica é um tipo de estereoisomeria (isomeria espacial) em que compostos possuem a mesma fórmula molecular e conectividade entre átomos, mas diferem na orientação espacial dos grupos em torno de uma ligação rígida, como uma ligação dupla (C=C) ou um cicloalcano.
-
Requisitos para ocorrer:
-
Ligação dupla C=C (com dois substituintes diferentes em cada carbono) ou
-
Estrutura cíclica (como ciclopropano, ciclobutano, etc.) com substituintes diferentes.
-
2. Exemplos
(a) Em Alcenos (Ligação Dupla C=C)
-
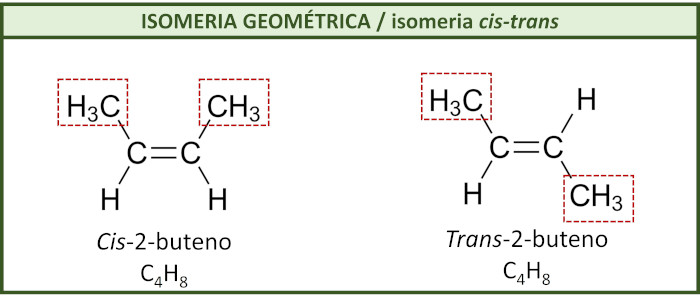
Isomeria geométrica- cis trans- Imagem: Manual da Química
(b) Em Cicloalcanos
-
1,2-dimetilciclopropano:
-
Cis-1,2-dimetilciclopropano (ambos CH₃ do mesmo lado do plano do anel).
-
Trans-1,2-dimetilciclopropano (CH₃ em lados opostos).
-
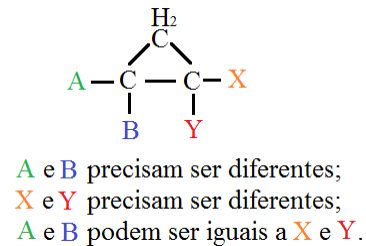
Isomeria em compostos cíclicos – Imagem: manual da Química
-
(c) Nomenclatura E-Z (para casos complexos)
-
Usada quando há mais de dois substituintes diferentes.
-
Prioridade de grupos: Regras de Cahn-Ingold-Prelog (maior número atômico primeiro).
-
Exemplo (Cl vs Br):
-
E- (entgegen → opostos)
-
Z- (zusammen → juntos)
-
-
Isomeria geométrica E-Z
A isomeria E-Z é uma forma de ocorrência da isomeria geométrica aplicada em moléculas com carbonos trissubstituídos e tetrassubstituídos, ou seja, que possuem três ou quatro ligantes diferentes.
Nesse sistema são analisados os grupos substituintes ligados a cada átomo de carbono da insaturação, e a cada um deles é atribuído uma ordem de prioridade. A denominação E ou Z é definida de acordo com a orientação espacial dos dois grupos de maior prioridade. Átomos de maior número atômico têm maior prioridade:

-
- Se houver empate entre os grupos substituintes na primeira ligação, aplicam-se os mesmos critérios de prioridade à ligação seguinte.
-
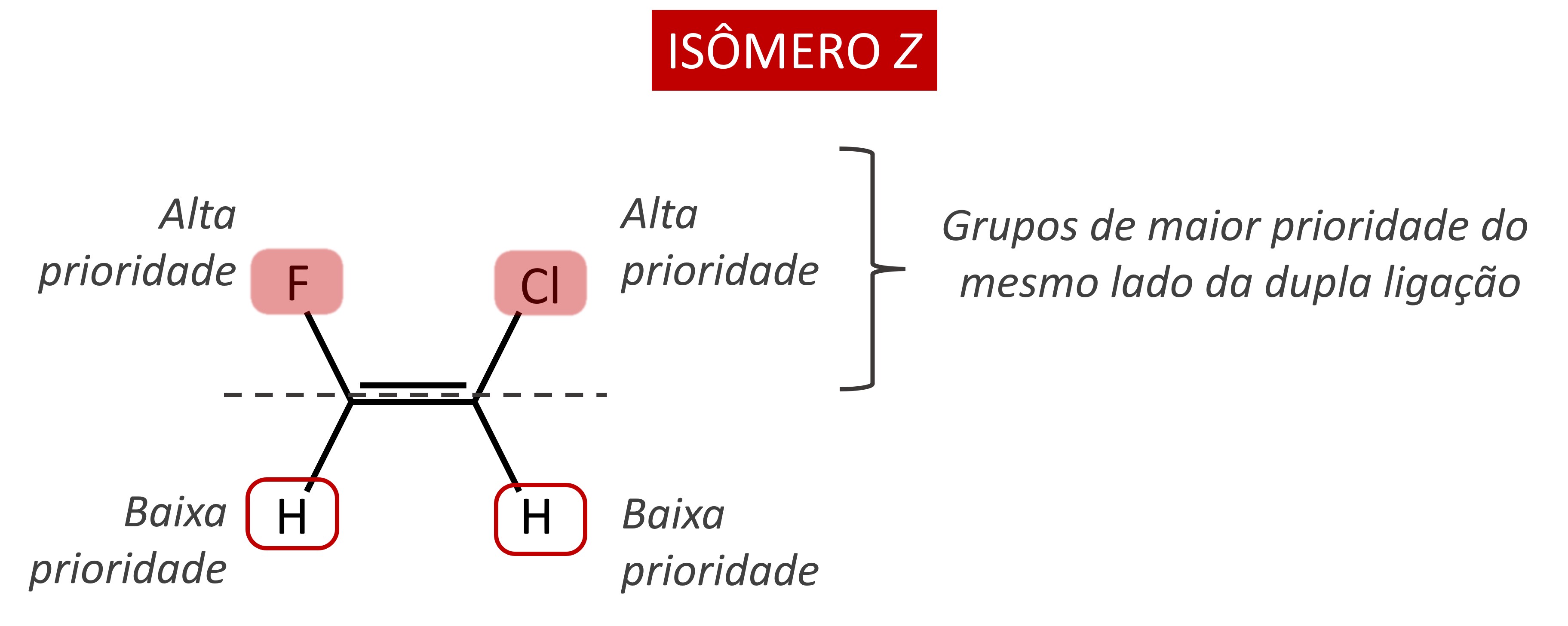
Isômero Z
Se os grupos de maior prioridade estiverem no mesmo lado do plano imaginário que passa pelos carbonos da dupla ligação, os isômeros são denominados Z. Essa letra faz referência ao termo alemão Zusammen, que possui sentido de “juntos”.
-
-
-
Isômero E
Quando os grupos de maior prioridade se apresentam em lados opostos da ligação dupla, a isomeria da molécula é definida como E. Essa letra faz referência ao termo alemão Entgegen, que possui sentido de “opostos”.
-
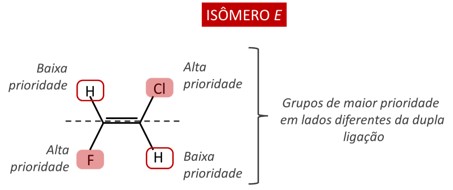
- ( https://www.manualdaquimica.com/)
3. Aplicações
-
Indústria Farmacêutica: Isômeros podem ter atividades biológicas diferentes (ex.: cisplatina vs. transplatina).
-
Polímeros: Propriedades físicas diferentes (ex.: borracha natural [cis] vs. borracha sintética [trans]).
-
Aromas e Sabores: Isômeros cis/trans podem ter odores distintos (ex.: ácido oleico [cis] vs. ácido elaídico [trans]).
4. Reações Importantes
-
Hidrogenação Catalítica: Converte alcenos cis/trans em alcanos.
-
Epoxidação: Mantém a geometria (ex.: cis-but-2-eno gera cis-epóxido).
-
Bromação: Forma dibrometanos anti (em trans-alcenos) ou meso (em cis).
5. Reconhecimento da Isomeria
-
Análise Espectroscópica:
-
RMN: Deslocamento químico diferente para prótons em isômeros cis/trans.
-
IR: Vibrações diferentes devido a interações estéricas.
-
-
Polaridade: Isômeros cis são geralmente mais polares que trans.
-
Ponto de Fusão/Ebulção: Isômeros trans têm maior simetria e PF mais alto.
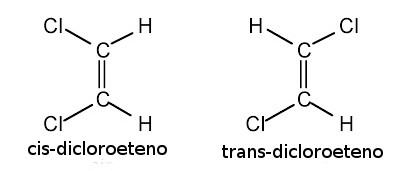
6. Fórmulas Estruturais
-
. Toxicidade (Exemplos)
-
Cisplatina (Pt(NH₃)₂Cl₂): Usada em quimioterapia (tóxica para rins).
-
Trans-platina: Menos ativa contra câncer, mas também tóxica.
-
Ácidos Graxos Trans: Presentes em óleos hidrogenados (aumentam risco cardiovascular).
Resumo Final
Característica Cis (Z) Trans (E) Polaridade Mais polar Menos polar PF/PE Menor Maior Reatividade Mais reativo (tensão estérica) Mais estável -
- imagem inicial: Wikipédia