ALÔ PESSOAL!
Setembro chegando no fim. E os vestibulares batendo na porta!!!
Vamos resolver exercícios de equilíbrio químico?
Aqui no XQUIMICA você encontra a teoria sobre equilíbrios químicos: http://xquimica.blogspot.com.br/2009/10/equilibrios-quimicos-missao.html
Agora, na resolução dos exercícios, precisamos de muita atenção!!!
Veja o exemplo abaixo:
( PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está representado pela equação:
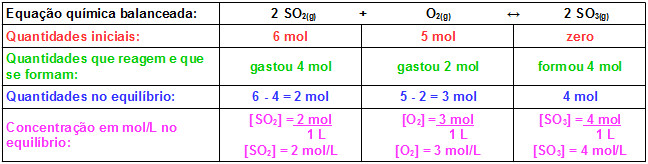
2SO2(g) + O2(g) ↔ 2SO3(g)
Em um recipiente de 1 litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de oxigênio. Depois de algum tempo, o sistema atingiu o equilíbrio; o número de mols de trióxido de enxofre medido foi 4. Qual o valor aproximado da constante de equilíbrio ?
Quando o exercício dá as concentrações iniciais e pede o Kc, você precisa saber quanto de cada substancia existe quando o equilíbrio foi atingido ( isso significa que a reação é reversível e a reação direta e a reação inversa tem a mesma velocidade)
Para isso é indicado você montar uma tabelinha para não se perder:
As quantidades iniciais são dadas no problema: 6 mol de SO2 e 5 mol de O2 .
Sendo assim, no inicio você não tem produtos.
Aí o problema fala que no equilíbrio foi encontrado 4 mol de trióxido de enxofre – que é o produto.( SO3 )
Agora para as contas da linha verde na tabela( lembre que os valores que tem na frente de cada substancia indicam o número de mol dessa substancia):
Dióxido de enxofre : tinha 6 mol gastou 4 ficou com 2 mol
Oxigênio : tinha 5 mol , gastou 2 mol ( porque você vai dividir o 4 mol da formação por 2, ficando 2 mol formado para cada SO3 como você tem 1 Oxigênio, gastou 2 mol ) ficando 3 mol de oxigênio no equilíbrio .
Na linha roxa você tem as quantidades, em mol, de cada substancia no equilíbrio.
Mas para calcular o Kc, você precisa da concentração em mol/ litro.
Por isso, na linha rosa foram feitos os cálculos para a molaridade de cada substancia.
Tendo isso sido feito, agora vamos calcular o Kc:
Kc = [SO3]2
[SO2]2 . [O2]
Kc = __(4)2__
(2)2 . 3
Kc = 1,33
Lembre que o Kc é calculado com os produtos na parte superior e os reagentes na parte inferior, elevados ao número de mols que acompanha a reação.