ALÔ PESSOAL!
Estamos na físico química ! E estudando para os vestibulares e ENEM!
Hoje o assunto é cinética química ou velocidade de uma reação.
Como ocorre uma reação?
Primeiro você precisa saber se, de fato, ela vai ocorrer!!!
As reações podem ser lentas ou rápidas:
 |
| imagem:alunosonline.com.br |
E quais são as condições?
1- os reagentes tem que estar em contato! meio obvio não?
2- eles precisam colidir, ou seja , ” bater” um no outro para que se rompam as ligações dos reagentes e se iniciem a formação dos produtos.
3- essas colisões tem que ser efetivas, produzindo resultados, do jeito certo.
 |
| imagem:mundoeducacao.bol.uol.com |
Quando as colisões ocorrem existe um estado intermediário, o complexo ativado, onde já não há reagentes e os produtos ainda não se formaram. Para que ocorra a formação do complexo ativado, as moléculas dos reagentes devem apresentar energia suficiente para que ocorra a reação: chama-se energia de ativação.(Ea)
 |
| imagem:3pb.blogspot.com |
Tanto as reações endotérmicas ( absorvem calor) quanto as exotérmicas ( liberam calor) formam o complexo ativado.
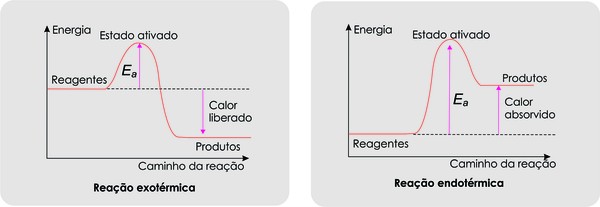 |
| imagem:s2.glbimg.com |
Também há fatores que podem influenciar a velocidade das reações:
- Concentração: quando maior a quantidade de reagentes, maior a possibilidade de colisões.
- Temperatura: aumento de temperatura, aumenta a agitação das moléculas, aumenta a possibilidade de colisões.
- Superfície de contato: quanto maior ela for, maior a possibilidade de colisões, logo quanto mais “dividido” estiverem os regentes, mais rápida a velocidade.
- Luz: aumenta a energia cinética das moléculas dos reagentes.
- Catalisadores são substancias capazes de aumentar a velocidade da reação sem participarem dela, ou seja, não são consumidas durante a reação.
