Propriedades coligativas são as propriedades das soluções que dependem do número de partículas dispersas e independem da natureza das partículas do soluto.
Os efeitos dos solutos nas propriedades físicas da água podem ser vistos em algumas situações comuns , por exemplo, como impedir o congelamento da água dos radiadores de carros em lugares muito frios; por que o açúcar acelera a cicatrização de feridas; por que adicionamos sal à carne a fim de conservá-la.
Os solutos são classificados em iônicos e moleculares.
( Se você tiver dúvida sobre esse assunto, veja a postagem anterior que fala sobre isso)
Os solutos iônicos são aqueles que possuem ligações iônicas como por exemplo o sal de cozinha, NaCl. Neste caso há uma dissociação dos íons e os mesmos ficam dispersos na solução.
Já os solutos moleculares possuem ligações covalentes e neste caso não há dissociação, mas as moléculas se dispõem isoladamente na solução. Um exemplo de soluto molecular é o açúcar (sacarose) C12H22O11.
.jpg) |
| fonte: alunosonline.uol.com.br |
As propriedades coligativas se dividem em:
Ebulioscopia ou Ebuliometria
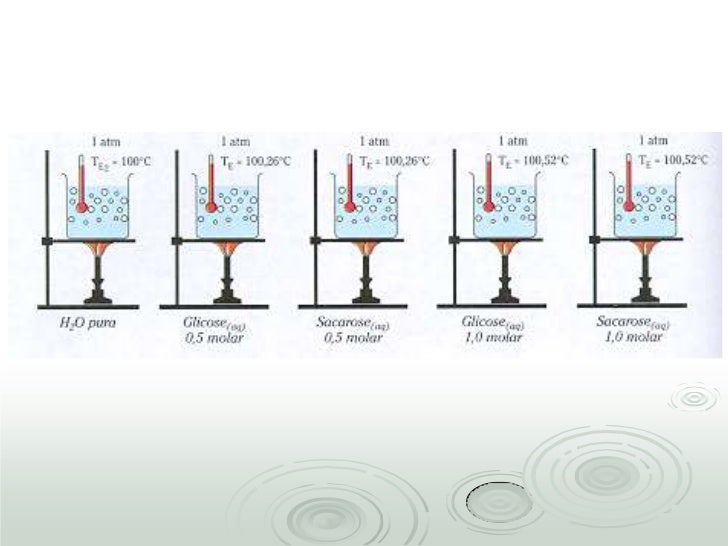
Este fenômeno ocorre por exemplo quando adicionamos açúcar na água do café que estava prestes a entrar em ebulição e ele retarda este ponto de ebulição devido a interação com o solvente. Em outras palavras, a ebulioscopia consiste no aumento da temperatura de ebulição, ou mais especificamente no aumento da variação da temperatura de ebulição devido à presença de partículas de soluto não-voláteis. A fórmula usada para o cálculo é:
ΔTe = Te2 – Te
Onde:
- Te = temperatura de ebulição da solução
- Te2 = temperatura de ebulição do solvente
 |
| fonte:image.slidesharecdn.com |
Tonoscopia ou Tonometria
Este processo pode ser também chamado de tonometria e consiste no abaixamento da pressão máxima de vapor de um solvente quando adicionado um soluto que não evapora.
Vale lembrar que a pressão máxima de vapor ocorre quando as velocidades de condensação e evaporação se tornam iguais e atinge-se um equilíbrio dinâmico. Esse processo ocorre quando adicionamos iodo (soluto não-volátil) à agua (solvente) por exemplo. A fórmula para o cálculo da Tonoscopia é:
Δp = P2 – P
Onde:
- P = pressão de vapor da solução
- P2 = pressão de vapor do solvente.
 |
| fonte: image.slidesharecden.com |
Crioscopia
Este fenômeno pode ser também chamado de criometria e é a razão pela qual consegue-se evitar o congelamento da água dos radiadores. Nos países muito frios as pessoas adicionam à água dos radiadores aditivos especiais que elevam o ponto de ebulição da água e também diminuem o seu ponto de solidificação ou congelamento. E quanto maior for a concentração desse aditivo na água, menor será a temperatura de congelamento. A fórmula que permite calcular essa propriedade é:
ΔTc = Tc2 – Tc
Onde:
- Tc = temperatura de congelamento da solução
- Tc2 = temperatura de congelamento do solvente
 |
| fonte:alunosonline.uol.com.br |
Pressão osmótica
Primeiro devemos definir o fenômeno da osmose, que é a passagem de solvente da solução menos concentrada para a mais concentrada através de uma membrana semipermeável. Isso ocorre por exemplo quando deixamos feijão de molho antes do cozimento. Podemos notar que os grãos do feijão ficam inchados. A pressão osmótica é a pressão que deve ser exercida sobre a solução a fim de barrar ou dificultar a passagem de solvente. A equação para seu cálculo é:
Onde:
- M= molaridade e n = número de mols = m1/Massa Molar
- R = constante dos gases
- T= temperatura em Kelvin
π= pressão osmótica
 |
| fonte: 2.bp.blogspot.com |
