ALÔ PESSOAL!!!
Quando se estuda concentrações, cálculo estequiométrico e propriedades coligativas, saber a diferença de comportamento das substancias moleculares e iônicas é muito importante.
Princípios:
Substancias moleculares
Os arranjos entre moléculas formam substâncias moleculares ou compostos moleculares. Essas substâncias se encontram à temperatura ambiente nos três estados físicos: sólido, líquido e gasoso.
A molécula de água é formada pela ligação entre dois átomos de hidrogênio (H) e um átomo de oxigênio (O). Essa molécula se encontra no estado líquido e é representada pela fórmula H2O:
H ― O ― H
A molécula de metano é formada pela ligação entre um átomo de carbono (C) e quatro átomos de hidrogênio, é representada pela fórmula CH4 (ver figura acima):
A água e o metano são substâncias moleculares, pois são formadas por moléculas. Além dessas, podemos citar como exemplos de substâncias moleculares: o açúcar (estado sólido), o álcool (estado líquido) e os gases em geral (estado gasoso).
Propriedades das substâncias moleculares:
Força intermolecular: a temperatura de ebulição (T.E.) de uma molécula é influenciada pela interação entre seus átomos (forças de atração intermoleculares): quanto mais intensa for a atração entre as moléculas, maior será a temperatura de ebulição.
Tamanho das moléculas: o tamanho de um composto molecular também influencia no seu ponto de ebulição. Quanto maior for a substância maior será sua superfície de contato, devido ao aumento das interações entre as moléculas, consequentemente a temperatura de ebulição irá aumentar.
Soluções moleculares
Soluções moleculares: são aquelas formadas por moléculas dissolvidas. São também chamadas de não eletrolíticas, pois não conduzem corrente elétrica. Por exemplo, se fizermos uma solução de água com açúcar (C12H22O11) , perceberemos (de acordo com a equação abaixo) que não há separação do soluto, portanto, trata-se de uma solução constituída por moléculas dissolvidas, molecular.
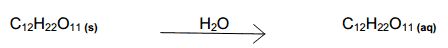
Substancias iônicas:
Íons são átomos em desequilíbrio elétrico e apresentam carga positiva ou negativa.
Arranjos entre compostos iônicos formam substâncias iônicas, também chamadas de compostos iônicos. A união entre os íons acontece em consequência das forças de atração eletrostática, elas ocorrem a todo o momento ao nosso redor, onde existem cargas elétricas de sinais opostos se atraindo.
A atração entre os íons produz aglomerados com formas geométricas definidas que recebem o nome de retículos cristalinos. Nesse retículo, cada ânion atrai simultaneamente vários cátions e cada cátion também atrai simultaneamente vários ânions.
O cloreto de sódio (o sal de cozinha) é um exemplo de substância iônica, formada por inúmeros aglomerados iônicos. O arranjo entre os cátions sódio (Na+) e os ânions cloreto (Cl–) se atraem fortemente por terem cargas contrárias, e formam a substância cloreto de sódio, que é um retículo cristalino de formato geométrico cúbico. Os sais e outros grupos de minerais possuem íons que formam compostos iônicos e, consequentemente, substâncias iônicas.
As principais características desses compostos se devem à existência do retículo iônico.
Propriedades das substâncias iônicas:
• Apresentam alto ponto de fusão (PF) e ponto de ebulição (PE).
• São sólidas à temperatura ambiente (25°C) e apresentam forma definida.
• Quebram-se facilmente quando são submetidas a impactos, e produzem faces planas, são, portanto, cristais duros e quebradiços.
• O melhor solvente dessas substâncias é a água.
• Conduzem corrente elétrica no estado líquido (fundido) e quando estão dissolvidas em água. Essa propriedade é devido à existência de íons com liberdade de movimento.
Soluções iônicas:
as soluções capazes de conduzir corrente elétrica são chamadas de soluções eletrolíticas ou soluções iônicas, pois a condutibilidade deve-se à presença de íons no meio.
Esses íons podem ser provenientes de dois processos:
* Dissociação iônica: ocorre quando é dissolvido um composto iônico. Por exemplo, o sal de cozinha (NaCl – cloreto de sódio) é formado por íons sódio (Na+) e cloreto (Cl–), que são unidos por uma ligação iônica, ou seja, eles ligaram-se por uma transferência de elétrons que fez com que os átomos transformassem-se em íons (o sódio perdeu um elétron, ficando com carga +1, e o cloro ganhou um elétron, ficando com carga -1).
Mas quando o cloreto de sódio é adicionado à água, a parte positiva das moléculas de água atrai o Cl–, e a parte negativa da água atrai o Na+, separando-os. Dessa forma, esses íons ficam dispersos na solução.
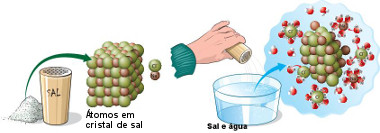 Dissociação iônica do sal na água
Dissociação iônica do sal na água
* Ionização: Ocorre quando um soluto molecular reage com a água e formam-se íons que não existiam antes no composto.
Por exemplo, o HCl é formado por uma ligação covalente (compartilhamento de um par de elétrons), portanto, é molecular. Mas ao ser colocado na água, ele é separado e forma os íons H+ e Cl–.
Agora que você já sabe a diferença entre cada uma das soluções, imagine a mesma quantidade de soluto que contenha em um frasco, açúcar, e em outro frasco, sal de cozinha.
Como vimos o açúcar não ioniza, mas o sal de cozinha sim. E isso faz muita diferença se você estiver trabalhando com número de mols dissolvidos na solução.
Em uma solução molecular, a quantidade de mol/litro que é colocada no inicio, permanece quando está em solução: 10 mol/ litro de açúcar em água serão 10 mol/ litro de açúcar em solução.
Mas o pensamento é diferente quando se trata de íons.
Quando colocamos 10 mol/ litro de sal de cozinha em água, teremos 20 mol/ litro de sal ionizado, o que aumenta a interação dos íons com a água influenciando as propriedades coligativas e o cálculo estequiométrico.( Na+ + Cl- = 2 íons)
Quanto maior o número de íons dissolvidos, em relação à solução molecular, teremos menor pressão de vapor, maior temperatura de ebulição, menor temperatura de congelamento.
Claro, que a quantidade de moléculas, dentro da solução molecular também faz diferença: se no TOTAL, for em quantidade maior, ela será a que provocará os efeitos coligativos.
Tudo depende da quantidade de soluto que está dentro do solvente e da temperatura.
Exemplos de íons dissolvidos:
|
Soluto
|
Concentração, mol.L-1
|
Cada molécula corresponde a
|
Total de partículas dispersas
|
| NaCl |
0,01
|
2 íons (Na + (sol)) + Cl –(sol))
|
2 x 0,01 x 6,02×1023
|
| NaCl |
0,1
|
2 íons (Na + (sol)) + Cl –(sol))
|
2 x 0,1 x 6,02×1023
|
| MgCl2 |
0,01
|
3 íons (Mg 2+ (sol)) +2 Cl –(sol)) |
3 x 0,01 x 6,02×1023
|
| MgCl2 |
0,1
|
3 íons (Mg 2+(sol)) +2 Cl –(sol))
|
3 x 0,1 x 6,02×1023
|
Exemplos de moléculas dissolvidas:
|
Soluto
|
Concentração, mol.L-1
|
Cada molécula corresponde a
|
Total de partículas dispersas
|
| Glicose |
0,01
|
1 partícula
|
1 x 0,01 x 6,02×1023
|
| Glicose |
0,1
|
1 partícula
|
1 x 0,1 x 6,02×1023
|
| Etilenoglicol |
0,01
|
1 partícula
|
1 x 0,01 x 6,02×1023
|
| Etilenoglicol |
0,1
|
1 partícula
|
1 x 0,1 x 6,02×1023
|
fontes: http://educacao.uol.com.
http://infoescola.com.
Pense agora: se você tiver 1 litro com 2,0 mol/ litro de sacarose e 1 litro com 1,0 mol / litro de nitrato de alumínio, qual das duas substancias provocará o maior abaixamento da pressão de vapor?

