ALÔ PESSOAL!!!!
Última propriedade coligativa : osmometria!
Vamos lembrar de alguns conceitos importantes:
difusão- é o movimento espontâneo entre partículas de substancias diferentes que se misturam, dando origem a uma solução.
Exemplos- os gases se misturam e se distribuem uniformemente em um recipiente; nos vasos comunicantes os líquidos se movimentam até os níveis se igualarem; o calor passa de um corpo mais quente para um corpo mais frio até que as temperaturas se igualem;
membrana semipermeável– é a que permite a passagem do solvente e impede a passagem do soluto.
OSMOSE é a passagem do solvente de uma região pouco concentrada em soluto para uma mais concentrada em soluto, sem gasto de energia.
PRESSÃO OSMÓTICA:
Quando temos um sistema hipotético à 20º C, com dois compartimentos separados por uma membrana semipermeável, e em um compartimento temos água pura e no outro uma solução, chamamos de Pressão Osmótica a força que deverá ser aplicada para parar a osmose neste sistema.
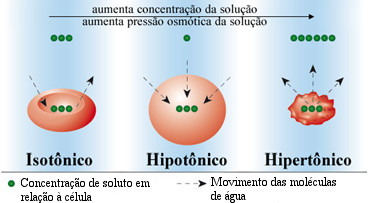
TIPOS DE SOLUÇÕES DE ACORDO COM A OSMOSE:
Solução hipertônica: Solução que está mais concentrada em soluto que o meio;
Solução hipotônica: Solução que está menos concentrada em soluto que o meio;
Solução Isotônica: Quando a concentração de soluto na célula e no meio são iguais.
OSMOSE REVERSA:
Usada para obtenção de água potável através do uso de água do mar.
Onde encontramos exemplos de osmose?
– no sangue humano onde os glóbulos vermelhos estão calibrados para viverem sob uma pressão osmótica de 7,8 atm. Por isso o soro fisiológico injetado nas veias do paciente deve ter sais dissolvidos em quantidade tal que a pressão osmótica do soro seja também de 7,8 atm.
-flores recém cortadas , quando colocadas em água, as pétalas ficam enturgecidas
– frutas secas, quando colocadas em água, incham
-verduras cruas, temperadas com sal, murcham
-subida da seiva até a parte mais altas das árvores
– conservação de alimentos: salgados ou muito doces fazem com que as células dos microrganismos que poderiam deteriorar os alimentos, perderem água por osmose o que acaba por matá-los.
fonte: Química- Feltre – volume 2
