ALCADIENOS
1. Definição
- Alcadienos são hidrocarbonetos insaturados que possuem duas ligações duplas carbono-carbono na estrutura.
- Eles podem ser subdivididos em três tipos, dependendo da posição das duplas ligações:
- Cumulados: as duas duplas estão no mesmo átomo de carbono (ex.: alenos, C=C=C).
- Conjugados: as duplas são alternadas com uma ligação simples (ex.: 1,3-butadieno, CH₂=CH-CH=CH₂ – fórmula estrutural abaixo.
- Isolados: as duplas estão separadas por duas ou mais ligações simples (ex.: 1,4-pentadieno, CH₂=CH-CH₂-CH=CH₂).
-
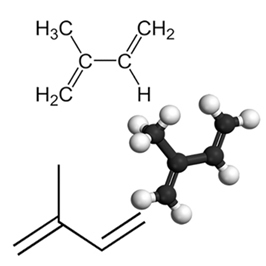
fórmulas estruturais do alcadieno : but-1,3- dieno
2. Compostos e Fórmulas
Exemplos de alcadienos simples:
- 1,3-butadieno (C₄H₆): CH₂=CH-CH=CH₂ (conjugado).
- Propadieno (aleno) (C₃H₄): CH₂=C=CH₂ (cumulado).
- 1,4-pentadieno (C₅H₆): CH₂=CH-CH₂-CH=CH₂ (isolado).
3. Usos
- Produção de polímeros: Alcadienos conjugados, como o 1,3-butadieno, são amplamente utilizados na produção de borrachas sintéticas (ex.: borracha de estireno-butadieno usada em pneus).
- Indústria petroquímica: Como intermediários na fabricação de plásticos, tintas e adesivos.
- Compostos aromáticos: Podem ser precursores na síntese de compostos aromáticos e outros produtos químicos.
4. Onde são encontrados
- Naturalmente: Alguns alcadienos estão presentes em óleos essenciais de plantas.
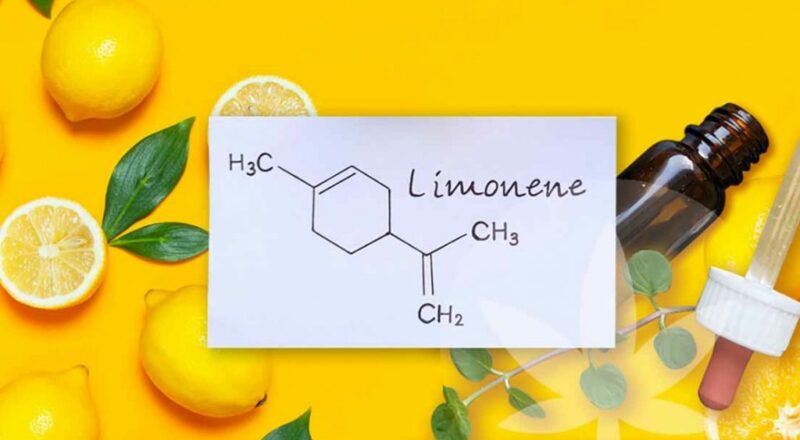
- Óleos essenciais: Os terpenos estão presentes em óleos essenciais extraídos de sementes, flores, raízes, folhas, madeira, cascas de frutas, entre outros. Eles possuem cheiro muito agradável e são usados em cosméticos e perfumes.
Um exemplo é o limoneno encontrado na casca do limão e da laranja mostrado a seguir:

Limoneno – óleo extraído da casca do limão ou da laranja* Cores: A cor alaranjada tão intensa da cenoura e de outros vegetais ocorre pela presença do betacaroteno, um terpeno capaz de absorver a cor verde-azulada, que tem comprimentos de onda entre 400 e 500 nm e reflete a sua cor complementar, que é o amarelo-alaranjado. Ela consegue absorver esses comprimentos de onda exatamente porque tem duplas ligações conjugadas, sendo assim, os elétrons têm uma mobilidade maior, o que, nesse caso, corresponde ao comprimento de onda do verde-azulado.

O betacaroteno é o responsável pela cor da cenoura* Borracha: o látex das seringueiras contém um polímero natural chamado de poli-isopreno, pois é resultado da adição sucessiva de várias unidades de isopreno. Essa seiva é extraída e usada na produção da borracha natural. ( https://www.manualdaquimica.com/)

seiva da seringueira – borracha – imagem: Manual da Química - Sinteticamente: São frequentemente obtidos por processos petroquímicos, como o craqueamento térmico de hidrocarbonetos.
5. Benefícios
- Indústria: Sua utilização é essencial na produção de borrachas, plásticos e outros materiais de uso cotidiano.
-
Alguns plásticos produzidos com alcadienos – imagem: Manual da Química - Versatilidade: São úteis como intermediários químicos para diversas sínteses industriais.
6. Malefícios
- Toxicidade: Alguns alcadienos, como o 1,3-butadieno, são considerados tóxicos e cancerígenos em altas exposições.
- Impacto ambiental: Podem ser poluentes atmosféricos e contribuir para a formação de smog fotoquímico.
7. Reações principais
- Adição eletrofílica: Reação típica de hidrocarbonetos insaturados. Exemplo:
- 1,3-butadieno reage com HCl para formar clorobuteno.
- Polimerização:
- Polimerização do 1,3-butadieno para formar borrachas sintéticas.
- Oxidação: Reagem com oxidantes fortes, formando ácidos ou outros derivados.
- Reações de Diels-Alder:
- Alcadienos conjugados reagem com dienófilos para formar compostos cíclicos.
CICLANOS E CICLENOS
1. Ciclanos (Cicloalcanos)
Definição
- Ciclanos são hidrocarbonetos cíclicos saturados que possuem apenas ligações simples (C-C) entre os átomos de carbono, formando anéis.
- Fórmula geral: CₙH₂ₙ, onde “n” é o número de átomos de carbono no anel (n ≥ 3).
-
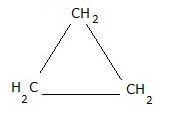
ciclano mais simples – ciclopropano- imagem: Toda Matéria
Exemplos comuns
- Ciclopropano (C₃H₆): Menor cicloalcano com três carbonos.
- Ciclobutano (C₄H₈): Anel com quatro carbonos.
- Ciclohexano (C₆H₁₂): O mais estável, amplamente estudado devido às suas conformações (cadeira e bote).
Usos
- Solventes: Alguns ciclanos são usados como solventes em processos industriais.
- Indústria de polímeros: Servem como intermediários na produção de plásticos e outros materiais.
- Combustíveis: Alguns cicloalcanos são componentes de combustíveis, aumentando sua eficiência.
- O ciclopentano é um gás que possui propriedades anestésicas e é muito utilizado para adormecer pacientes que passarão por cirurgias. O cicloalcano mais simples, o ciclopropano, também é um potente anestésico.
- Outro ciclano importante é o ciclo-hexano, ele é usado como combustível, como solvente e removedor de tintas e vernizes, além de servir como ponto de partida para a produção do ácido adípico, COOH(CH2)4COOH, que é matéria-prima para a fabricação do náilon.( https://www.preparaenem.com)
Onde são encontrados
- Naturalmente: Presentes em compostos como óleos essenciais e derivados do petróleo.
- Produção sintética: Obtidos a partir de reações como hidrogenação de compostos cíclicos insaturados.
Benefícios
- Estabilidade química dos maiores ciclanos (como o ciclohexano) torna-os úteis como solventes.
- Versatilidade em reações químicas permite a síntese de diversos produtos industriais.
Reações importantes
- Substituição por halogênios: Exemplo: cloração do ciclopropano para formar clorociclopropano.
- Hidrogenação: Redução de compostos insaturados para formar ciclanos.
- Oxidação controlada: Formação de álcoois ou ácidos carboxílicos.
- Craqueamento: Divisão de cadeias maiores em produtos mais simples.
2. Ciclenos (Cicloalcenos)
Definição
- Ciclenos são hidrocarbonetos cíclicos insaturados que possuem uma ou mais ligações duplas entre átomos de carbono no anel.
- Fórmula geral: CₙH₂ₙ₋₂, dependendo do número de ligações duplas.
-
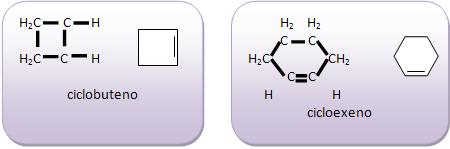
Ciclenos- cadeias fechadas com uma dupla ligação- imagens: Colégio Web
Exemplos comuns
- Ciclopenteno (C₅H₈): Ciclo com uma dupla ligação.
- Ciclohexeno (C₆H₁₀): Um dos ciclenos mais estáveis devido ao tamanho do anel.
- 1,3-Ciclohexadieno (C₆H₈): Possui duas duplas conjugadas.
Usos
- Indústria química: Precursores na produção de polímeros e resinas.
- Síntese orgânica: Usados como intermediários em reações para criar compostos mais complexos.
- Aromáticos: Ciclenos insaturados são intermediários para a formação de compostos aromáticos como benzeno.
Onde são encontrados
- Na natureza: Alguns são encontrados em produtos naturais como terpenos.
- Indústria petroquímica: Produzidos por processos de craqueamento ou ciclação.
Benefícios
- Sua reatividade os torna úteis na síntese de compostos químicos de alto valor agregado.
- Importância na produção de polímeros e borrachas sintéticas.
Reações importantes
- Adição eletrofílica: Reagem com halogênios (Br₂, Cl₂) para formar derivados halogenados.
- Hidrogenação: Adição de H₂ para formar ciclanos.
- Reações de Diels-Alder: Ciclenos com duplas conjugadas reagem com dienófilos para formar compostos cíclicos maiores.
- Oxidação: Formação de diálcoois ou epóxidos.
Resumo Comparativo
| Propriedade | Ciclanos | Ciclenos |
|---|---|---|
| Fórmula geral | CₙH₂ₙ | CₙH₂ₙ₋₂ |
| Saturação | Saturados (apenas ligações simples) | Insaturados (uma ou mais duplas) |
| Reatividade | Relativamente baixa | Alta devido à insaturação |
| Usos principais | Solventes, combustíveis | Síntese de polímeros, compostos intermediários |
| Exemplo comum | Ciclohexano | Ciclohexeno |