OS PRINCIPAIS CONCEITOS
Átomo
Definição: O átomo é a menor unidade de um elemento químico que mantém suas propriedades químicas. Ele é composto por três tipos principais de partículas subatômicas:
- Prótons: Partículas com carga positiva localizadas no núcleo.
- Nêutrons: Partículas sem carga elétrica (neutras), também localizadas no núcleo.
- Elétrons: Partículas com carga negativa que orbitam ao redor do núcleo em regiões chamadas de camadas ou níveis de energia.
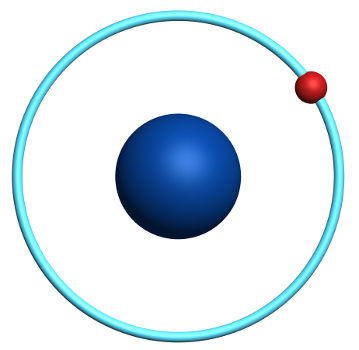
Exemplo: O átomo de Hidrogênio é o átomo mais simples e é composto por um próton, um nêutron e um elétron. Seu símbolo químico é H, e sua representação é frequentemente mostrada como um círculo (núcleo) com um ponto (elétron) ao redor.
Molécula
Definição: Uma molécula é uma combinação de dois ou mais átomos unidos por ligações químicas. As moléculas podem ser formadas por átomos do mesmo elemento ou de elementos diferentes.
Exemplos:
- Molécula de Oxigênio (O₂): Composta por dois átomos de oxigênio unidos por uma ligação dupla. É uma molécula diatômica porque tem dois átomos.
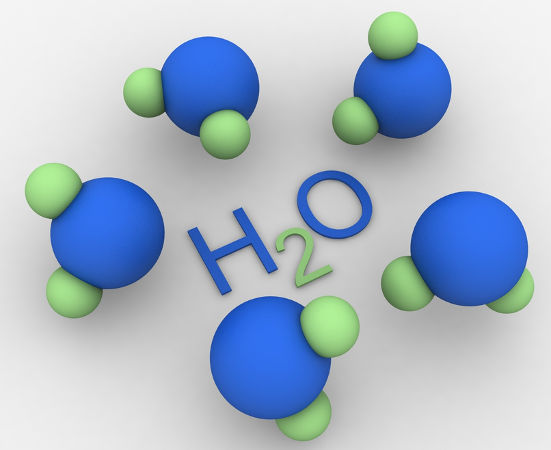
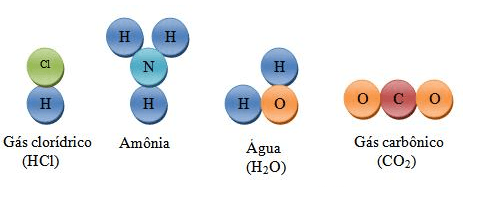
- Molécula de Água (H₂O): Composta por dois átomos de hidrogênio e um átomo de oxigênio, unidos por ligações covalentes. A fórmula química indica a proporção dos átomos na molécula.
Substância
Definição: Uma substância é um tipo de matéria que tem uma composição química uniforme e propriedades distintas. Pode ser classificada em dois tipos principais: substâncias simples e substâncias compostas.
Substância Simples
Definição: Uma substância simples é aquela que é composta apenas por um tipo de átomo ou molécula. Em outras palavras, ela não pode ser decomposta em substâncias mais simples por métodos químicos comuns.

Exemplos:
- Oxigênio (O₂): É uma substância simples composta por moléculas diatômicas de oxigênio.
- Ouro (Au): É um elemento puro que consiste apenas em átomos de ouro.
Substância Composta
Definição: Uma substância composta é formada por dois ou mais tipos diferentes de átomos quimicamente combinados em uma proporção fixa. As substâncias compostas podem ser decompostas em substâncias mais simples através de reações químicas.
Exemplos:
- Água (H₂O): É uma substância composta formada por átomos de hidrogênio e oxigênio. Pode ser decomposta em hidrogênio e oxigênio por eletrólise.
- Dióxido de Carbono (CO₂): Composto por um átomo de carbono e dois átomos de oxigênio. Pode ser decomposto em carbono e oxigênio em condições específicas.
Resumo das Relações
- Átomo: A menor unidade de um elemento. Exemplo: Átomo de Hidrogênio.
- Molécula: Conjunto de átomos unidos por ligações químicas. Pode ser de uma substância simples (O₂) ou composta (H₂O).
- Substância Simples: Formada por apenas um tipo de átomo ou molécula. Exemplo: Ouro (Au), Oxigênio (O₂).
- Substância Composta: Formada por dois ou mais tipos de átomos ou moléculas. Exemplo: Água (H₂O), Dióxido de Carbono (CO₂).
ÍON:
Definição: Íons são átomos ou moléculas que carregam uma carga elétrica devido a um desequilíbrio no número de prótons e elétrons. Se um átomo ou molécula tiver mais elétrons do que prótons, ele terá uma carga negativa e será chamado de ânion. Se tiver mais prótons do que elétrons, terá uma carga positiva e será chamado de cátion.
Formação dos íons:
A formação de íons ocorre quando átomos ou moléculas ganham ou perdem elétrons, alterando o seu equilíbrio de carga elétrica.
1. Formação de Cátions
Definição: Um cátion é um íon com carga positiva. É formado quando um átomo perde um ou mais elétrons.
Exemplo:
- Sódio (Na): Um átomo de sódio tem 11 prótons e 11 elétrons. Se ele perde um elétron, ele fica com 11 prótons e 10 elétrons, resultando em uma carga positiva de +1. Assim, forma-se o cátion sódio Na+
Equação:
Na ——-> Na+ + e –
2. Formação de Ânions
Definição: Um ânion é um íon com carga negativa. É formado quando um átomo ganha um ou mais elétrons.
Exemplo:
- Cloro (Cl): Um átomo de cloro tem 17 prótons e 17 elétrons. Se ele ganha um elétron, ele terá 17 prótons e 18 elétrons, resultando em uma carga negativa de -1. Assim, forma-se o ânion cloreto Cl –
- Equação: Cl ——-> Cl– + e –
Importância dos Íons
Os íons desempenham papéis essenciais em muitos processos químicos e biológicos:
- Equilíbrio Eletrolítico: Íons são cruciais para o equilíbrio eletrolítico no corpo, ajudando a manter funções vitais como a transmissão de impulsos nervosos e a contração muscular.
- Condutividade Elétrica: Soluções de sais ionizados conduzem eletricidade. Por exemplo, a água salgada (solução de cloreto de sódio) conduz eletricidade devido à presença de íons : Na+ Cl–
- Reações Químicas: Muitos processos químicos e reações, como a formação de sais e ácidos, envolvem a troca de íons.
Exemplos de Íons Comuns
- Cátion Sódio (Na⁺): Formado quando o sódio perde um elétron. É comum em soluções salinas.
- Ânion Cloreto (Cl⁻): Formado quando o cloro ganha um elétron. É encontrado em muitos sais, como o sal de cozinha (NaCl).
- Cátion Cálcio (Ca²⁺): Formado quando o cálcio perde dois elétrons. Importante para a formação de ossos e dentes.
- Ânion Sulfato (SO₄²⁻): Formado quando o ácido sulfúrico se dissocia em solução. Comum em fertilizantes e detergentes.
Resumo
- Íons: Átomos ou moléculas com carga elétrica devido à perda ou ganho de elétrons.
- Cátions: Íons positivos formados pela perda de elétrons.
- Ânions: Íons negativos formados pelo ganho de elétrons.


