ALÔ PESSOAL!!!
Já descobrimos como ocorre uma reação e as condições para que isso aconteça.
Agora, vamos calcular essa velocidade!
Velocidade Média de uma reação:
Durante uma reação química, os reagentes são consumidos para que os produtos sejam formados. Por essa razão, podemos calcular a velocidade em que um reagente é consumido ou a velocidade em que um produto é formado, por exemplo. Em ambos os casos, sempre vamos realizar o cálculo a partir da relação entre a variação da concentração e a variação do tempo:
v = |Δ[ ]|
Δt
Δt
Observação: O módulo |Δ[ ]| é necessário porque a velocidade não pode ser negativa. Além disso, existe a possibilidade de, ao calcular a variação da concentração (Δ[ ]), o resultado ser negativo (principalmente nos reagentes, pois a concentração final é menor que a inicial).
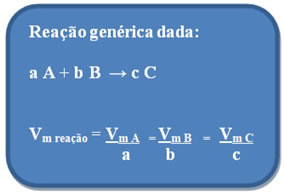
Para determinar a velocidade média em que uma reação (vr) é processada, devemos obrigatoriamente conhecer a velocidade (vx) de qualquer um dos participantes da reação e dividi-la pelo seu coeficiente estequiométrico da reação:
vr = vx
n
n
Para exemplificar os cálculos da velocidade em uma reação química, vamos utilizar como base a equação que representa a reação de formação da amônia.
1 N2 + 3 H2 → 2 NH3
Nessa reação, o N2 e o H2 são reagentes, enquanto o NH3 é o produto. À medida que o tempo passa, a quantidade de reagentes diminui e a quantidade de produtos aumenta, de acordo com a tabela a seguir:
.jpg)
Utilizando os dados acima, é possível determinar a velocidade de cada um deles em qualquer intervalo de tempo. Para exemplificar, determinaremos a velocidade de cada um no intervalo de 0 a 2 minutos de reação:
Para o N2
→ A concentração varia de:
Δ[ ] = |0,1 – 0,2|
Δ[ ] = 0,1 mol/L
→ O tempo varia de:
Δt = 2 – 0
Δt = 2 min
→ A velocidade de consumo de N2 será, então:
v = |Δ[ ]|
Δt
Δt
v = 0,1
2
2
v = 0,05 mol.L-1.min-1
Para o H2
→ A concentração varia de:
Δ[ ] = |0,3 – 0,6|
Δ[ ] = 0,3 mol/L
→ O tempo varia de:
Δt = 2 – 0
Δt = 2 min
→ A velocidade de consumo de N2 será, então:
v = |Δ[ ]|
Δt
Δt
v = 0,3
2
2
v = 0,15 mol.L-1.min-1
Para o NH3
→ A concentração varia de:
Δ[ ] = |0,2 – 0|
Δ[ ] = 0,2 mol/L
→ O tempo varia de:
Δt = 2 – 0
Δt = 2 min
→ A velocidade de formação de NH3 será, então:
v = |Δ[ ]|
Δt
Δt
v = 0,2
2
2
v = 0,1 mol.L-1.min-1
A velocidade média da reação de formação do NH3 pode ser determinada por meio de qualquer uma das velocidades conhecidas de qualquer um dos participantes da reação. Nós dividiremos a velocidade deles pelo coeficiente da reação. A tabela a seguir traz o cálculo feito com as velocidades e os coeficientes dos três participantes:

Analisando a tabela, podemos concluir que o resultado do cálculo da velocidade média de uma reação será o mesmo independentemente do participante utilizado no cálculo.
De uma forma geral:
 |
| alunosonline.uol.com.br |
fonte:http://manualdaquimica.uol.com.br

