ENTALPIA- CONCEITO
A entalpia é uma propriedade termodinâmica fundamental que representa a quantidade total de energia de um sistema, incluindo a energia interna e a energia associada à pressão e ao volume do sistema. É frequentemente utilizado em processos químicos e físicos para avaliar a troca de calor em reações e transformações de fase. O conceito de entalpia é especialmente útil em sistemas de pressão constante.
As reações podem ser endotérmicas ou exotérmicas.
Reações endotérmicas são àquelas nas quais a energia é absorvida do ambiente, levando ao aumento da entalpia do sistema.
Por outro lado, nas reações exotérmicas a energia é liberada como forma de calor para o ambiente, levando à diminuição da entalpia do sistema.
Reação Endotérmica é aquela em que há absorção de energia. Nesse processo, a energia é produzida e, de forma independente, é mantida.
As aves e os mamíferos têm a capacidade de manter a estabilidade da temperatura do corpo. Por esse motivo eles são chamados de animais endotérmicos, popularmente, “animais de sangue quente”.
Reação Exotérmica é aquela em que há liberação de energia. Nesse processo, a produção de energia somente persiste mediante o fornecimento contínuo de calor.
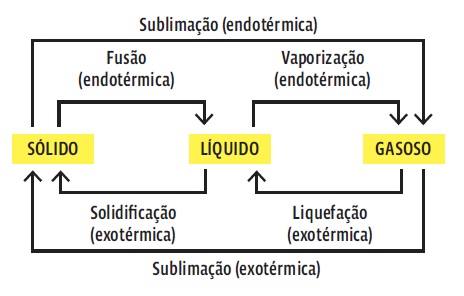
Os processos físicos que conhecemos como solidificação e evaporação, fazem parte desse processo abaixo:
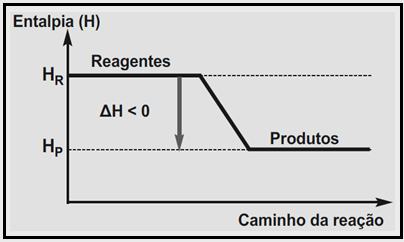
ENTALPIA DAS REAÇÕES ENDOTÉRMICAS:
Uma reação endotérmica é uma reação química cuja energia total (entalpia) dos seus produtos é maior que a de seus reagentes, ou seja, ela absorve energia (na forma de calor). Um exemplo seria a decomposição da bauxita, para obtenção de alumínio.

Cálculo da entalpia de uma reação endotérmica:
ΔH= Hp – Hr ( variação de entalpia é igual à entalpia dos produtos menos a entalpia dos reagentes.)
Nesse caso, o ΔH > 0 , ΔH Positivo .
Exemplo:
½ H2(g) + ½ I2 (g) -> HI(g) (ΔH = +6,2 Kcal/mol ou +25,92 KJ/mol) ou seja, essa reação necessita de calor para ser efetuada.
2C(s) + H2(g) -> C2H2(g) (ΔH = +53,5 Kcal/mol ou +223,63 KJ/mol)
obs: as energias dos reagentes e dos produtos são fornecidas em uma tabela, ou calculadas através da energia de ligação.
Cálculo de energia de uma reação exotérmica
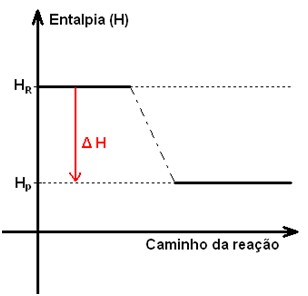
ΔH= Hp – Hr ( variação de entalpia é igual a produtos menos reagentes, nesse caso ΔH < 0 , liberando energia )
Exemplos:
½ O2(g) + H2(g) -> H2O(l) (ΔH = -68,3 Kcal/mol ou -285,49 KJ/mol)
½ H2(g) + ½ Cl2(g) -> HCl(g) (ΔH = -22,0 Kcal/mol ou -91,96 KJ/mol)
ENERGIA DE LIGAÇÃO
Para que novas moléculas sejam formadas, é necessário que as ligações entre os átomos sejam quebradas e novas ligações estabelecidas.
A energia de ligação é a energia absorvida na quebra da ligação entre átomos no estado gasoso e em condições normais de temperatura e pressão. A energia de ligação, ou entalpia de ligação, é a energia absorvida na quebra de um mol de ligação, no estado gasoso, entre átomos a 25 oC e 1 atm.
Exemplo:
H2 + Cl2 –> 2HCl
Nessa reação, uma molécula de gás hidrogênio e uma de gás cloro são quebradas entre si e unidas depois para formar o ácido clorídrico. Através de experiências em laboratório determinou-se que a entalpia de ligação do hidrogênio (H-H) é de 104 kcal/mol, do cloro (Cl-Cl) é 58 kcal/mol e do ácido clorídrico (H-Cl) é de -103 kcal/mol. O cálculo é expresso assim:
ΔH = 2 HCl – (H2 + Cl2)
ΔH = 2 * (-103) – (-104 + (-58))
ΔH = – 206 + 162
ΔH = – 44 kcal/mol ( thtps://www.infoescola.com)
E onde estão essas energias de ligação entre os átomos?
Em tabelas, que são fornecidas na hora de fazer o exercício.
(Mackenzie-SP) O gás propano é um dos integrantes do GLP (gás liquefeito de petróleo) e, dessa forma, é um gás altamente inflamável. Abaixo está representada a equação química de combustão completa do gás propano.
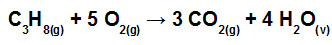
Na tabela, são fornecidos os valores das energias de ligação, todos nas mesmas condições de pressão e temperatura da combustão.
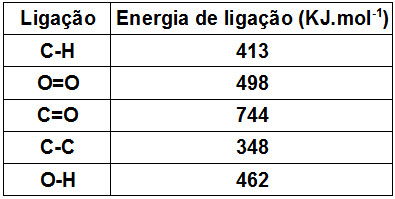
Assim, a variação de entalpia da reação de combustão de um mol de gás propano é igual a
a) – 1670 kJ.
b) – 6490 kJ.
c) + 1670 kJ.
d) – 4160 kJ.
e) + 4160 kJ.
resolução:
Letra a). Com os valores de energia fornecidos pelo exercício, devemos fazer o seguinte para resolver a questão:
1º Passo: Escrever a equação representando a fórmula estrutural de cada um dos participantes da equação:
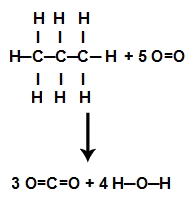
2º Passo: Calcular a energia total das ligações nos reagentes. Para isso, devemos multiplicar o valor da energia da ligação entre os átomos envolvidos pelo coeficiente estequiométrico na equação e pelo número de vezes que ela se repete na estrutura. Por fim, basta somar os valores.
H reagentes = 2.(C-C) + 8. (C-H) + 5. (O=O)
H reagentes = 2.(348) + 8.(413) + 5.(498)
H reagentes = 696 + 3304 +2490
H reagentes = 6490 KJ.mol-1
OBS.: Nos reagentes, a energia é sempre absorvida, logo, o valor dela nos reagentes é sempre positivo.
3º Passo: Calcular a energia total das ligações nos produtos. Para isso, devemos multiplicar o valor da energia da ligação entre os átomos envolvidos pelo coeficiente estequiométrico na equação e pelo número de vezes que ela se repete na estrutura. Por fim, basta somar os valores.
H produtos = 6.(C=O) + 8. (O-H)
H produtos = 6.(744) + 8.(462)
H produtos = 4464 + 3696
H produtos = 8160 KJ.mol-1
OBS.: Nos produtos, a energia é sempre liberada, logo, o valor dela nos produtos é sempre negativo:
Hprodutos = – 8160 KJ.mol-1
4º Passo: Utilizar os valores encontrados para reagentes e produtos na seguinte fórmula:
ΔH= H produtos + H reagentes
ΔH= – 8160 + 6490
ΔH= – 1670 KJ.mol-1
https://exercicios.brasilescola.uol.com.br/
ENERGIA DE COMBUSTÃO
A combustão é uma reação de uma substância (combustível) com o oxigênio (O2) (comburente) presente na atmosfera, com liberação de energia. Quando ΔH > 0 isto significa que a energia do(s) produto(s) é maior que a energia do(s) reagentes(s) e a reação é endotérmica, ou seja, absorve calor do meio ambiente.
A combustão completa é a que possui quantidade de oxigênio suficiente para consumir o combustível. Ela apresenta como produtos o CO2 (Dióxido de Carbono) e a H2O (Água).
A combustão completa apresenta maior liberação de calor.
Exemplos:
a) Combustão completa do etanol (C2H6O):
C2H6O + O2 → CO2 + H2O
Ao balancear a reação:
C2H6O + 3 O2 → 2 CO2 + 3 H2O
Entalpia de combustão
A entalpia (H) de combustão ou calor de combustão consiste na energia liberada na queima de 1 mol de combustível, em condições de estado padrão (Temperatura: 25 °C; Pressão: 1 atm).
Pelo fato da combustão ser uma reação exotérmica, a variação de entalpia (∆H) sempre terá valor negativo.
uma explicação pelo vídeo!!!