EQUILÍBRIO QUÍMICO
O equilíbrio químico é um fenômeno que acontece nas reações químicas reversíveis entre reagentes e produtos.
Quando uma reação é direta, está transformando reagentes em produtos. Já quando ela ocorre de maneira inversa, os produtos estão transformando-se em reagentes.
Para ocorrer um equilíbrio químico é necessário que:
- a temperatura seja constante
- o sistema não tenha trocas com o ambiente
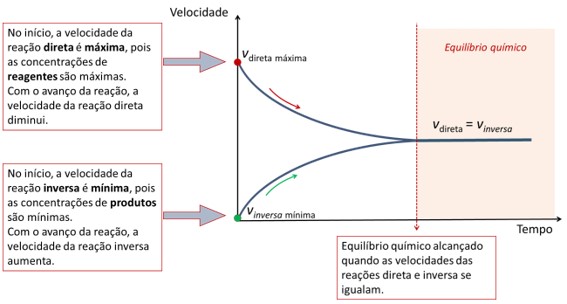
Quando um ponto de equilíbrio é atingido nas reações reversíveis tem-se:
- a velocidade das reações direta e inversa iguais.
- a concentração constante das substâncias presentes na reação.
O equilíbrio químico é medido por duas grandezas: a constante de equilíbrio e o grau de equilíbrio.
Ele pode ser alterado quando ocorre mudanças de: concentração, temperatura, pressão e uso de catalisadores.
Reações Químicas Reversíveis
Exemplo de equação química:
No primeiro membro (antes da seta) aparecem os reagentes, ou seja, as substâncias que entram na reação.
No segundo membro (depois da seta) estão os produtos, isto é, as substâncias que foram formadas pela reação.
Em uma reação reversível ela pode ocorrer nos dois sentidos (representado por ):
Assim, nas reações diretas os reagentes formam produtos (reagentes → produtos). Já nas reações inversas, os produtos formam reagentes (produtos → reagentes). ( https://www.todamateria.com.br/)
PRINCÍPIO DE LE CHATELIER:

Aplicação
Equilíbrios químicos são essenciais em diversos processos industriais e biológicos:
- Indústria química: A produção de amônia pelo processo de Haber-Bosch e a síntese do ácido sulfúrico no processo de contato dependem do controle do equilíbrio químico para maximizar a eficiência.
- Biologia: Muitas reações no organismo, como a regulação do pH no sangue através do equilíbrio entre ácido carbônico e bicarbonato, dependem do equilíbrio químico.
- Farmacologia: Medicamentos e soluções tamponantes se baseiam em equilíbrios para controlar efeitos no corpo humano.
Causas de Mudanças no Equilíbrio
Mudanças no equilíbrio químico podem ser causadas por diversos fatores, conforme o Princípio de Le Chatelier:
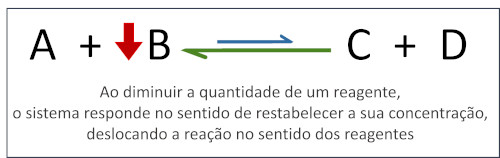
- Concentração: Alterar a concentração de um reagente ou produto desloca o equilíbrio para restabelecer uma nova situação de equilíbrio.
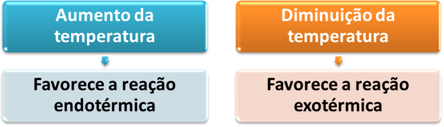
- Temperatura: O aumento da temperatura favorece a reação endotérmica (que absorve calor) e, ao diminuir, favorece a reação exotérmica (que libera calor).
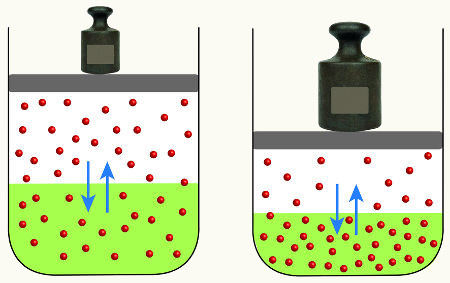
- Pressão (em gases): Mudanças na pressão alteram o equilíbrio em reações gasosas; o aumento da pressão favorece o lado com menor número de moléculas gasosas.
- Catalisadores: A introdução de catalisadores acelera tanto a reação direta quanto a inversa, permitindo que o equilíbrio seja atingido mais rapidamente, mas sem alterar as concentrações finais.

EXERCÍCIO COMPLETO PASSO A PASSO :
“Exemplo: (PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está representado pela equação:
![]()
Em um recipiente de um litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de oxigênio. Depois de algum tempo, o sistema atingiu o equilíbrio, e o número de mols de trióxido de enxofre medido foi 4. O valor aproximado da constante de equilíbrio é:
a) 0,53
b) 0,66
c) 0,75
d) 1,33
e) 2,33
Resposta correta: Letra D
O exercício pede para calcular a constante de equilíbrio em termos de concentração mol/L. Para esse cálculo ser realizado, devemos utilizar valores no equilíbrio de cada participante da reação. A expressão do Kc apresenta o resultado da multiplicação das concentrações dos produtos dividido pelo produto das concentrações dos reagentes:
![]()
Devemos ter muito cuidado para determinar os valores de cada participante no equilíbrio, pois nem sempre o exercício fornecerá esses dados, como é o caso desse exemplo. Assim, devemos seguir os passos abaixo:
Passo 1: Montar uma tabela com os valores conhecidos.
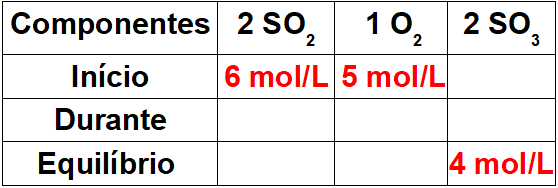
Por ser o início da reação, o produto irá apresentar uma concentração igual a zero. Como o valor do equilíbrio no produto é sempre igual à soma do início e do durante, o valor durante a reação será 4 mol/L.
.jpg)
Passo 2: Determinar os valores durante a reação.
Para determinar os valores dos reagentes durante a reação, basta relacionarmos o valor conhecido para o produto com os valores dos reagentes por meio da proporção estequiométrica. Temos 4 mol/L de SO3 durante a reação para a proporção 2 no balanceamento. Como a proporção do SO2 também é 2, teremos 4mol/L durante o processo. Para o O2, teremos apenas 2 mol/L, pois seu coeficiente estequiométrico é 1.

Para finalizar a tabela, basta subtrairmos o valor do início pelo valor do durante, pois, assim, determinaremos os valores do equilíbrio para os reagentes.
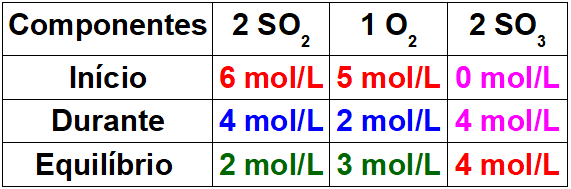
Passo 3: Determinar o valor do Kc.
Para determinar o valor do Kc, basta utilizarmos os valores encontrados no equilíbrio na expressão abaixo:

https://brasilescola.uol.com.br/quimica/equilibrio-quimico.htm

