ALÔ PESSOAL!
Conforme o post anterior, vamos entender, resolvendo um exercício calculando a variação de entalpia de uma reação através das energias de ligação dos componentes da reação.
Exercício:
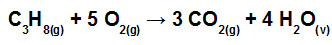
 ( C3H8) nessa fórmula você vê 8 ligações entre o carbono e o hidrogênio ( C—H )
( C3H8) nessa fórmula você vê 8 ligações entre o carbono e o hidrogênio ( C—H )
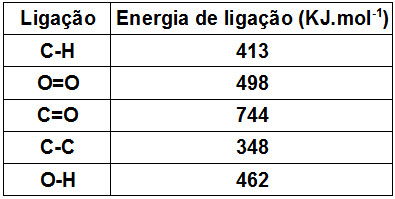
Se cada ligação vale 413, então teremos 413 x 8 = 3304.
Cada ligação C—-C vale 348 e temos duas, logo, 348 x 2 = 696. Somando os dois valores: 3304 + 696 = 4000, na fórmula do gás propano.
Agora a ligação O=O ( O2) : são 5 x 498= 2490
Na parte dos reagentes teremos: (gás propano = 4000) + (gás oxigênio = 2490) total de 6490
Vamos discutir o sinal desse valor. Quando estamos quebrando ligações, precisamos de energia. Logo, o rompimento das ligações dos reagentes, para formar os produtos, é uma reação endotérmica, recebe energia, e o H reagentes é sempre positivo: + 6490 kj
Agora vamos aos produtos: CO2 – gás carbônico
CO2 – gás carbônico
Cada ligação C=O vale 744. Como temos 2 ligações–> 2 x 744= 1488. Mas veja na fórmula, são 3 CO2. Então vamos multiplicar o valor 1488 x 3 = 4464.
Agora a água : H2O – água
H2O – água
cada ligação O-H vale 462. Em uma molécula de água temos 2 ligações, logo, 2 x 462 = 924.
Mas na fórmula temos 4 mol de água , então 4 x 924= 3696.
Somando tods os produtos: ( CO2 = 4464) +( H2O = 3696) = 8160
Vamos discutir o sinal deste valor:quando as ligações estão quebradas e vão formar novos produtos, sempre há liberação de energia, ou seja, é uma reação exotérmica, com H negativo.
Logo H produtos = – 8160 kj
Para resolver de vez:
ΔH = H produtos + H reagentes = – 8160 + 6490 = – 1460 kj/ mol
Lembre que é uma reação de combustão, logo vai liberar calor! E a entalpia final será menor que a inicial.
Nesse tipo de problema, você usa esse método, com uma adição entre as duas partes da reação. Não faça o ΔH da forma convencional, porque sairá errado…
fontes:www.brasilescola.uol.com
quimicona1.blogspot.com
