FAMÍLIA VIIB OU GRUPO B
O grupo (B), é o grupo conhecido como grupo do Manganês. Que é constituído dos seguintes elementos:
- Manganês (Mn)
- Tecnécio (Tc)
- Rênio (Re)
- Bóhrio (Bh)
Manganês (Mn)
- Nome: Manganês
- Número atômico: 25
- Número de massa: Aproximadamente 55 (isótopos estáveis mais comuns)
- Configuração eletrônica: [Ar] 3d5 4s2
- Estado físico: Sólido à temperatura ambiente
- Onde é encontrado: É encontrado principalmente na forma de minerais, como a pirolusita (MnO2).
- Utilidades: Utilizado na produção de ligas metálicas (aço inoxidável, por exemplo), em baterias recarregáveis (níquel-manganês), na produção de pilhas secas, em pigmentos (óxidos de manganês), entre outros.Uma das características mais interessantes do manganês é a sua capacidade de assumir muitos estados de oxidação diferentes, proporcionando ampla diversidade de compostos químicos formados com outros elementos.
Apesar de ser frágil em sua forma pura, quando compõe ligas metálicas, o manganês é capaz de aumentar a maleabilidade e a resistência das ligas. A siderurgia é o setor que consome quase todo o manganês extraído da natureza.
O manganês é um nutriente essencial às plantas e aos animais, inclusive aos humanos, por participar do ciclo de atividade de várias enzimas, sob a forma de íons Mn2+. Na alimentação, esse nutriente pode ser obtido pela ingestão de oleaginosas, nozes, amendoins, avelãs, sementes, mariscos e alguns legumes folhosos.(https://mundoeducacao.uol.com.br)
- Malefícios: O excesso de manganês pode causar problemas neurológicos e respiratórios em humanos, sendo associado a condições como a doença de Parkinson.
- Reações importantes: Participa em diversas reações redox, especialmente na forma de íons Mn2+ e Mn3+.
- Solubilidade em água: O manganês metálico não é solúvel em água, mas seus compostos como Mn2+ podem estar em solução, dependendo do pH e da natureza do composto.
-

elemento manganês- família VIIB – grupo 7- tabela periódica- imagem: InfoEscola
Tecnécio (Tc)
- Nome: Tecnécio
- Número atômico: 43
- Número de massa: Vários isótopos radioativos (mais estáveis são Tc-98 e Tc-99)
- Configuração eletrônica: [Kr] 4d5 5s2
- Estado físico: Sintético; não ocorre naturalmente em quantidades detectáveis
- Onde é encontrado: Produzido artificialmente em reatores nucleares e usado em medicina nuclear para diagnósticos.
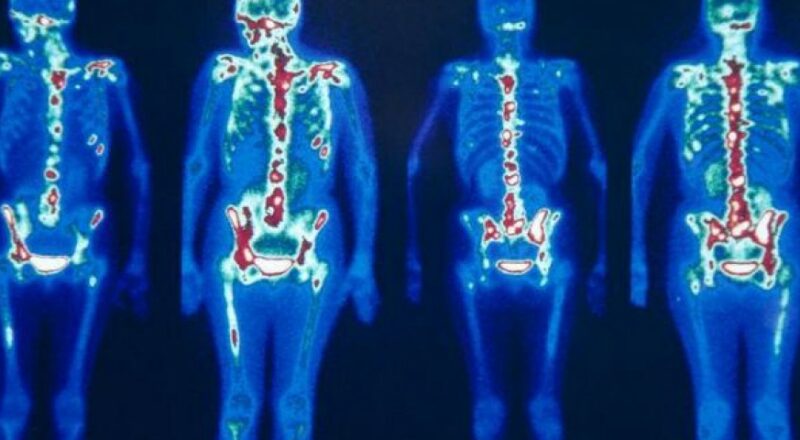
- Utilidades: Utilizado em cintiladores, como fonte de radiação em medicina nuclear e em estudos de traçadores radiativos.A cintilografia óssea é um exame de medicina nuclear que visa avaliar as doenças que afetam os ossos, podendo ser tanto doenças malignas como também benignas, ou seja, que resultam de câncer ou não. Neste exame todos os ossos do esqueleto são visualizados e podem ser analizados. Ele pode ver alterações funcionais que outros não mostram, por isso diz-se que é mais sensível.
Como é feito:
O exame de cintilografia óssea acontece em dois momentos: primeiramente, o paciente recebe a aplicação do radiofármaco (Tecnécio 99). Após a medicação, o paciente aguarda um período de 3 a 4 horas para que a medicação chegue ao destino desejado. Passado esse período o paciente realiza o exame.(https://www.clinicabionuclear.com.br/) a imagem do inicio da postagem também pertence a este texto.
- Malefícios: Como é radioativo, o tecnécio apresenta riscos associados à radiação para a saúde humana.
- Reações importantes: Participa em processos de fissão nuclear e reações radioativas.
- Solubilidade em água: Os compostos de tecnécio podem variar em solubilidade dependendo de sua natureza química específica.
-

elemento tecnécio- família VIIB- grupo B- tabela periódica imagem:Traços de tecnécio já foram encontrados em amostras rochosas de pechblenda, mineral rico em urânio.” https://brasilescola.uol.com.br/quimica/tecnecio-tc.htm -
Rênio (Re)
- Nome: Rênio
- Número atômico: 75
- Número de massa: Aproximadamente 186 (isótopo mais estável é o Re-185)
- Configuração eletrônica: [Xe] 4f14 5d5 6s2
- Estado físico: Sólido à temperatura ambiente
- Onde é encontrado: Encontrado em minérios de molibdênio e cobre, bem como em minerais de sulfeto.
- Utilidades: Utilizado em superligas de alta temperatura, catalisadores de reforma de nafta, termopares e em dispositivos eletrônicos.
- Malefícios: O rênio é considerado de baixa toxicidade em sua forma metálica, mas compostos solúveis podem ser tóxicos.
- Reações importantes: Participa em processos catalíticos, como a hidrogenação de substratos orgânicos.
- Solubilidade em água: O rênio metálico é insolúvel em água.
-

elemento rênio- família VIIB- grupo 7 – tabela periódica. imagem: Molibdenite, principal fonte de extração do rênio – Wikipedia
Bohrio (Bh)
- Nome: Bohrio
- Número atômico: 107
- Número de massa: Aproximadamente 270 (isótopo mais estável é o Bh-270)
- Configuração eletrônica: [Rn] 5f14 6d5 7s2
- Estado físico: Sintético; não ocorre naturalmente em quantidades detectáveis
- Onde é encontrado: Produzido artificialmente em laboratórios nucleares, em reações nucleares de alta energia.
- Utilidades: Devido à sua instabilidade e à sua produção sintética em quantidades extremamente pequenas, o bohrio não tem aplicações práticas conhecidas além de estudos científicos.
- Malefícios: Não há informações específicas sobre os malefícios do bohrio devido à sua natureza extremamente rara e altamente radioativa.
- Reações importantes: Participa em estudos sobre a estrutura e a síntese de elementos superpesados.
- Solubilidade em água: Não há informações específicas sobre a solubilidade do bohrio devido à sua natureza sintética e rara.
-

elemento bóhrio- representação – família VIIB- grupo B – tabela periódica – imagem: Escola Educação