HIDROCARBONETOS
Definição:
Hidrocarbonetos são compostos orgânicos formados por cadeias de átomos de carbono ligados entre si e a átomos de hidrogênio. Eles podem ser classificados de acordo com a estrutura de suas ligações entre os carbonos.
Composição:
A composição dos hidrocarbonetos é simples, consistindo apenas de carbono (C) e hidrogênio (H), mas suas propriedades variam amplamente dependendo da fórmula.
Tipos de hidrocarbonetos
Os hidrocarbonetos podem ser classificados em dois grupos principais com base nas ligações entre carbonos:
- Hidrocarbonetos Saturados (Alcanos):
- Definição: São ligações simples.
- Exemplo: Metano (CH₄), etano (C₂H₆), propano (C₃H₈).
- Fórmula geral: CnH2n+2
- Hidrocarbonetos Insaturados:
- Definição: São compostos que possuem pelo menos uma ligação dupla ou tripla entre os átomos de carbono.
- Tipos:
- Alquenos (com pelo menos uma ligação dupla): Exemplo: Eteno (C₂H₄).
- Alquinos (com pelo menos uma ligação tripla): Exemplo: Etino (C₂H₂).
- Fórmula geral dos alquenos: CnH2n
- Fórmula geral dos alquinos: CnH2n-2
- Hidrocarbonetos Aromáticos:
- Definição: São compostos que contêm anéis de átomos de carbono com ligações alternadas simples e duplas, conhecidos como anéis aromáticos.
- Exemplo: Benzeno (C₆H₆), tolueno (C₆H₅CH₃).
Exemplos de Hidrocarbonetos:
- Metano (CH₄): Principal componente do gás natural, utilizado como combustível.
- Etano (C₂H₆): Usado como matéria-prima para a produção de eteno e outros compostos químicos.
- Benzeno (C₆H₆): Usado como solvente e na produção de plásticos e outros produtos químicos.
- Propano (C₃H₈): Usado como gás combustível, especialmente em fogões e aquecedores.
Onde se Encontram:
Os hidrocarbonetos estão amplamente presentes em fontes naturais, como:
- Petróleo: Principal fonte de hidrocarbonetos, extraído e refinado para produzir gasolina, diesel, querosene, e outros produtos.
- Gás Natural: Rico em metano, utilizado como fonte de energia e matéria-prima.
- Carvão: Contém hidrocarbonetos e pode ser processado para a obtenção de outros produtos químicos.
- Biomassa: Alguns hidrocarbonetos também são encontrados em matéria orgânica, como plantas e animais.
Usos e Aplicações:
- Combustíveis:
- Hidrocarbonetos são amplamente utilizados como combustíveis fósseis (gás natural, gasolina, diesel, querosene) devido à sua alta densidade energética.
- Indústria Química:
- São usados como matéria-prima na produção de plásticos, borrachas sintéticas, detergentes, e outros produtos químicos.
- Solventes:
- O benzeno e outros hidrocarbonetos aromáticos são usados como solventes industriais.
- Gás:
- O gás natural, que é rico em metano, é usado para aquecimento, cozinhar e na geração de eletricidade.
- Indústria Farmacêutica:
- Compostos derivados de hidrocarbonetos são usados na produção de medicamentos, perfumes e outros produtos de consumo.
- Plásticos:
- Hidrocarbonetos como o etileno e propileno são percussores para a produção de plásticos, como o polietileno e polipropileno.
ESTUDO DOS ALCANOS:
Os alcanos são um tipo de hidrocarboneto saturado, ou seja, compostos químicos formados apenas por átomos de carbono e hidrogênio, onde todos os átomos de carbono estão ligados por ligações simples. Eles são conhecidos como parafinas e são os hidrocarbonetos mais simples e estáveis.
Composição dos Alcanos:
- Os alcanos são compostos formados apenas por átomos de carbono (C) e hidrogênio (H).
- Eles são chamados de hidrocarbonetos saturados porque cada átomo de carbono está ligado a tantos átomos de hidrogênio quanto possível, sem formar ligações duplas ou triplas.
- A fórmula geral dos alcanos é CnH2n+2 onde n é o número de átomos de carbono na molécula.
Exemplos de Alcanos Importantes:
- Metano (CH₄):
- O metano é o alcano mais simples, composto por um átomo de carbono e quatro átomos de hidrogênio.
- É o principal componente do gás natural e utilizado como combustível.
-

gás metano – imagem: Todo Estudo
- Etano (C₂H₆):
- Composto por dois átomos de carbono e seis de hidrogênio.
- Usado principalmente como matéria-prima para a produção de eteno (um composto importante na indústria química).
-
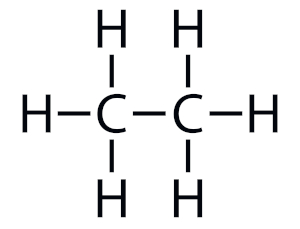
fórmula estrutural do etano- imagem: Manual da Química
- Propano (C₃H₈):
- Composto por três átomos de carbono e oito de hidrogênio.
- Usado como combustível em botijões de gás e também como matéria-prima na indústria petroquímica.
-

gás propano- fórmula estrutural- imagem: Passei Direto 
cilindro de gás propano da Coleman. Ele é usado como combustível para fogões e em motores de automóveis. A combustão do propano é uma reação tipicamente exotérmica com desprendimento de calor: C3H8 + 5 O2 → 3 CO2 + 4 H2O Outro uso do propano é como propulsor para sprays aerossóis, especialmente após o banimento dos CFCs. imagem: casa da Carabina
- Butano (C₄H₁₀):
- Composto por quatro átomos de carbono e dez de hidrogênio.
- Usado como combustível doméstico (como gás butano em fogões) e na produção de aerossóis.
-
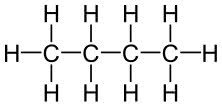
fórmula estrutural do butano- imagem: Toda Matéria 
Butano- O gás butano está presente nas residências e nas indústrias. Nesse sentido, pode ser utilizado como combustível de isqueiros, como matéria-prima na produção de borracha sintética, para o aquecimento das piscinas e saunas e como solvente nos aerossóis. imagem: Educa Mais Brasil
- Hexano (C₆H₁₄):
- Composto por seis átomos de carbono e quatorze de hidrogênio.
- Usado como solvente em indústrias e laboratórios.
-

hexano- fórmula estrutural- imagem: Quimicando 
hexano- imagem Mercado Livre
- Octano (C₈H₁₈):
- Composto por oito átomos de carbono e dezoito de hidrogênio.
- Importante como componente da gasolina.
- O número de octano de um combustível representa o percentual de isoctano (C8H18 ) e de heptano (C7 H16 ) contidos nele. Já o índice de octano mede a resistência de um combustível a se auto-inflamar. Quanto mais elevado for o índice, mais resistente é o combustível à detonação, é o fenômeno denominado de autodetonância.Mas o que seria a autodetonância? A detonação da gasolina acontece nos cilindros de motores de combustão interna, ela corresponde à combustão prematura durante a compressão exercida pelo pistão.( Mundo Educação – UOL )
-
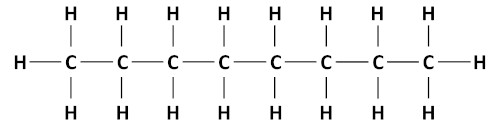
octano- fórmula estrutural – imagem: PrePara ENEM
Reações Importantes dos Alcanos:
Embora os alcanos sejam compostos relativamente estáveis, eles podem sofrer algumas reações importantes:
- Reação de Combustão:
- Os alcanos reagem com o oxigênio para formar dióxido de carbono e água, liberando grande quantidade de energia (calor). Essa é uma reação exotérmica.
- Exemplo: CH4+2O2→CO2+2H2O+energia
- Utilizado como combustível em veículos, fogões, aquecedores e usinas de energia.
- Cloração ou Bromação (Reação com Halogênios):
- Os alcanos podem reagir com halogênios (como cloro e bromo) em presença de luz ou calor, substituindo átomos de hidrogênio por átomos de halogênio, formando compostos halogenados.
- Exemplo: Cloração do metano: CH4+Cl2→CH3Cl+HCl
- Esses compostos halogenados podem ser usados em diversos produtos industriais, como solventes e refrigerantes.
- Cracking:
- O cracking é uma reação de quebra de moléculas grandes de alcanos, geralmente encontrados no petróleo, em compostos menores, como alquenos e alcanos menores.
- Essa reação ocorre em condições de alta temperatura e pressão, sendo um processo industrial importante para a obtenção de combustíveis e matéria-prima para a indústria petroquímica.
- Isomerização:
- A isomerização é um processo no qual alcanos podem ser convertidos em isômeros de cadeias ramificadas, o que melhora as propriedades do combustível (como o aumento da octanagem).
- Exemplo: O butano pode ser isomerizado para formar isobutano, que tem propriedades melhores para combustão.
Utilizações dos Alcanos:
- Combustível:
- Alcanos são a base de muitos combustíveis fósseis, como gás natural (rico em metano), gás de cozinha (butano e propano), e gasolina (contém alcanos como o octano).
- Matéria-Prima na Indústria Química:
- Alcanos servem como matéria-prima para a produção de compostos químicos mais complexos, como alquenos, álcoois, ácidos graxos e outros produtos petroquímicos.
- Gás Natural e Gás LP:
- O gás natural é composto principalmente por metano, utilizado para aquecer residências, cozinhar e gerar eletricidade.
- O gás liquefeito de petróleo (GLP), composto por propano e butano, é utilizado em fogões e aquecedores.
- Produção de Energia:
- A queima de alcanos em usinas termoelétricas ou motores de combustão interna é uma importante fonte de energia no mundo moderno.
- Solventes:
- Alguns alcanos, como o hexano, são usados como solventes em laboratórios e indústrias, especialmente na extração de óleos vegetais e na fabricação de adesivos.
- Produtos Industriais:
- Alcanos também são usados na produção de polímeros, plásticos e borrachas sintéticas, principalmente através do processo de polimerização.
Exemplos de Alcanos em Uso:
- Metano (CH₄): Usado como combustível doméstico e em usinas termoelétricas.
- Etano (C₂H₆): Utilizado na indústria petroquímica para produzir eteno.
- Propano (C₃H₈): Usado em fogões domésticos e como combustível de aquecimento.
- Butano (C₄H₁₀): Usado em isqueiros, aerossóis e como combustível doméstico.
- Hexano (C₆H₁₄): Usado na extração de óleos vegetais e como solvente industrial.

