Todo mundo conhece os efeitos da luz neon:

Mas como o gás neônio, que está dentro dos tubinhos, fica assim, iluminado? Isso tem a ver com os elétrons, que ficam nas camadas atômicas- ( aula 7)
Quando o ” luminoso é aceso” a energia faz com que os elétrons fiquem agitados e “pulem” para outra camada. mas a tendência é voltar para o seu lugar, e nessa volta, a energia que ele adquiriu vai embora, em forma de luz colorida- nesse caso- e/ ou calor.
Na aula passada, falamos das camadas que ficam em volta do núcleo e são 7 : K L M N O P Q . Mas cada camada dessas comporta um número determinado de elétrons.
Assim:

Então, no nível 1 temos a camada K que suporta somente 2 elétrons.
Mas como ficam esses elétrons dentro das camadas? De qualquer jeito, esbarrando uns nos outros? Claro que não! Química é bem pensada….
CONCEITO DE ORBITAL :
ORBITAL É A REGIÃO, DENTRO DA CAMADA OU NÍVEL, QUE TEM A MAIOR PROBABILIDADE DE SE ENCONTRAR UM ÉLETRON ESPECÍFICO.
Dessa forma, dentro de cada camada, tem um determinado número de orbitais que comportem a quantidade de elétrons. Os orbitais são quatro, chamados de : S,P,D,F . Aí que entra a luz do neon! Quando muda de nível ( camada) ou subnível , recebe energia , mas tem a tendência de retornar ao seu lugar.
Veja:
orbital S tem 2elétrons, no máximo
orbital P tem 6 elétrons, no máximo
orbital D tem 10 elétrons, no máximo
orbital F tem 14 elétrons, no máximo.
Agora a correspondência entre as camadas ou níveis e os orbitais ( ou subníveis ):

DIAGRAMA DE PAULING:
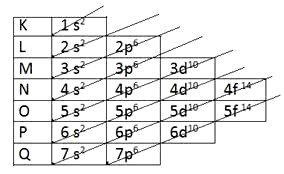
Presta atenção: No primeiro nível tem a camada K, que possui 2 elétrons. Então, somente o subnível S pode estar nessa camada.
No segundo nível, camada L, tem um total de 8 elétrons: então tem subnível S com 2 elétrons e subnível P com 6 elétrons = somando 8 elétrons no total.
E assim, camada por camada, você tem o número máximo de elétrons em cada subnível.
Então é possível localizar um elétron, dentro de um átomo?

Linus Pauling criou O diagrama. acima. Através dele, sabendo o NÚMERO ATÔMICO do elemento químico, podemos saber onde estão os elétrons e de que forma estão distribuídos!
Mas, lembre que, o diagrama foi construído de acordo com a energia dos orbitais ( s,p,d,f,) onde S é o mais fraco e F é o mais forte!
Exemplos:
1- Distribuição eletrônica do elemento Oxigênio ( Z=8) , ou seja, o número atômico é igual a 8.
😯 = fazendo pelo diagrama de Linus Pauling:
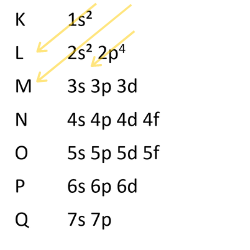
Lembre que o diagrama segue uma regra: de cima para baixo e sempre em linhas inclinadas e paralelas.
Sua distribuição eletrônica é: 1s² 2s² 2p4. Camada K (nível1) tem 2 elétrons. Camada L ( nível 2 ) tem 6 elétrons.
2- Distribuição eletrônica do ferro Z= 26
26Fe
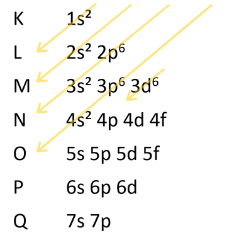
Número Atômico: 26
Distribuição eletrônica: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Camada K = 2 elétrons
Camada L= 8 elétrons
Camada M= 14 elétrons – conte todos que aparecem com o número 3 antes da letra.
Camada N= 2 elétrons

É gratuito?
o que significa “é gratuito”?
Se você se refere ao site, blog, Canal Xquimica no \Youtube, tudo é gratuito.
Atenciosamente
X-XQUIMICA