ALÔ PESSOAL !
Vamos de radioatividade?
A radioatividade é definida como o fenômeno pelo qual um núcleo instável emite partículas e ondas para atingir a estabilidade.
Nem todos os átomos são radioativos, mas os que recebem essa definição se caracterizam por emitir partículas radioativas (radiação), numa busca constante para se tornarem mais estáveis.
Um elemento pode emitir radiação, independente de seu estado físico (sólido, líquido ou gasoso) e de fatores químicos (temperatura e pressão em que se encontra), como por exemplo, o Urânio-238. Este isótopo, estando em qualquer estado físico ou mesmo ligado a outra espécie é, e sempre será, um elemento radioativo natural que emite radiações, sabe por quê? A radioatividade está relacionada diretamente com o núcleo atômico.
Os isótopos radioativos mais comuns são: urânio-238, urânio-235, césio-137, cobalto-60, tório-232, etc., sendo todos fisicamente instáveis e radioativos, ou seja, possuem uma constante e lenta desintegração.
Isótopos radioativos liberam energia (radiação) através de ondas eletromagnéticas (raios X e raios gama) ou partículas subatômicas em alta velocidade. O contato da radiação com seres vivos pode causar diversos males, dentro eles, o câncer.
As radiações que podem ser emitidas a partir do núcleo de um átomo são:
Alfa (2α4): radiação composta por 2 prótons e 2 nêutrons. Apresenta número atômico igual a 2 e número de massa igual a 4;
Beta (-1β0): radiação composta por 1 elétron. Apresenta número atômico igual a -1 e número de massa igual a 0.
OBS.: A radiação beta é um elétron produzido a partir da decomposição de um nêutron localizado no interior do núcleo de um átomo. Nessa decomposição, o nêutron (n) transforma-se em um próton (p), um neutrino ( ) e um elétron (β). Essa explicação, denominada de hipótese de Fermi, foi dada pelo físico italiano Enrico Fermi e é demonstrada pela equação abaixo:
) e um elétron (β). Essa explicação, denominada de hipótese de Fermi, foi dada pelo físico italiano Enrico Fermi e é demonstrada pela equação abaixo:
0n1 → 1p1 + 0 0 + -1β0
0 + -1β0
Gama (0γ0): radiação que é uma onda eletromagnética. Apresenta número atômico igual a 0 e número de massa igual a 0.
Leis da radioatividade
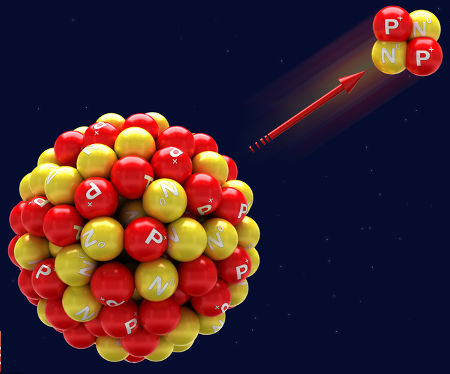
Representação da emissão de uma radiação alfaA 1ª lei da radioatividade trata da emissão de uma radiação alfa a partir do núcleo de um átomo. Como a radiação alfa apresenta número de massa igual a 4 e número atômico igual a 2, temos as seguintes alterações no núcleo do átomo:
-
Diminuição de 2 prótons e 2 nêutrons no núcleo do átomo.
-
Diminuição do número de massa em 4 unidades.
-
Diminuição do número atômico em 2 unidades.
Como há uma alteração no número de prótons no núcleo do átomo, sempre que uma radiação alfa é emitida, temos a formação de um novo elemento químico, cujo número atômico é duas unidades menor que o que deu origem a ele.
A equação química que representa os eventos que ocorrem na primeira lei da radioatividade é:
ZXA → 2α4 + Z-2YA-4
Agora acompanhe um exemplo de um átomo emissor de radiação alfa:
Exemplo:
84Po209 → 2α4 + 82Pb205
O Polônio apresenta número atômico 84 e número de massa 216. Ao emitir a radiação alfa, que apresenta número de massa 4 e número atômico 2, forma o elemento Chumbo, que, por sua vez, apresenta número atômico 82 e número de massa 212.
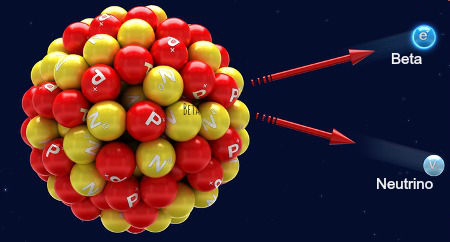
Representação da emissão de uma radiação betaA 2ª Lei da radioatividade trata da emissão de uma radiação beta a partir do núcleo de um átomo. Como a radiação beta apresenta número de massa 0 e número atômico -1, temos as seguintes alterações no núcleo do átomo:
-
Aumento de 1 próton no núcleo do átomo.
-
Manutenção do número de massa.
-
Aumento do número atômico em 1 unidade.
Como há uma alteração no número de prótons do núcleo do átomo, sempre que uma radiação beta é emitida, temos a formação de um novo elemento químico, cujo número atômico é 1 unidade maior que o que deu origem a ele.
A equação química que representa os eventos que ocorrem na segunda lei da radioatividade é:
ZXA → -1β0 + Z+1YA
Agora acompanhe um exemplo de um átomo emissor de radiação beta:
Exemplo:
92U238 → -1β0 + 93Np238
O Urânio apresenta número atômico 92 e número de massa 238. Ao emitir a radiação beta, forma o elemento Netúnio, que apresenta número atômico 93 e número de massa 238.
O número atômico aumenta em uma unidade e o número de massa não sofre alteração porque um nêutron transforma-se em um próton, um neutrino e beta, que é eliminada, como propõe a hipótese de Fermi:
0n1 → 1p1 + 0 0 + -1β0
0 + -1β0
Assim sendo, podemos concluir que a massa do nêutron era 1 e não sofreu alteração, pois o próton que ficou no núcleo também tinha número de massa 1. Já o número atômico aumentou uma unidade porque o próton formado permaneceu no núcleo, alterando, consequentemente, o número atômico.
fonte:http://mundoeducacao.bol.uol.com
 ) e um elétron (β). Essa explicação, denominada de hipótese de Fermi, foi dada pelo físico italiano Enrico Fermi e é demonstrada pela equação abaixo:
) e um elétron (β). Essa explicação, denominada de hipótese de Fermi, foi dada pelo físico italiano Enrico Fermi e é demonstrada pela equação abaixo: 0 + -1β0
0 + -1β0

 0 + -1β0
0 + -1β0