ALÔ PESSOAL!!!!!!!!!
Espero que tenham ” detonado” a prova de ontem!!!!!!!!!!!!
Aqui estão so testes de química, com resolução do Curso Objetivo, e em vermelho, minhas considerações.

Observem a cadeia inicial, cícilica, onde há 2 oxigenios.Na cadeia posterior, aberta, há tres oxigenios- um a mais – e 2 hidrogenios , além dos que já existiam. Isso é H2O, fórmula da água, o que sugere uma hidrólise, alternativa C
Observe que ,em ambos os gráficos, a concentração dos reagentes cai e a concentração dos produtos aumenta, até estabelecer o equilibrio. Portanto se as concentrações de hidrogenio gasoso e iodo gasoso estão diminuindo, a quantidade de ácido iodidrico formado será maior, o que faz a relação K1 ser maior que 1.
afirmações:
I. A velocidade da reação de Zn com ácido aumenta na presença de Cu.
II. O aumento na concentração inicial do ácido causa o aumento da velocidade de liberação do gás H2.
Com os dados contidos na tabela, a estudante somente
poderia concluir o que se afirma em
e) II e III.
A tabela coloca sempre 200 ml de ácido com concentração de 0,2 mol/ litro.Lógico que o zinco em pó ou em raspas tem uma velocidade maior devido ao aumento da superfície de contato, mas isso por si só não explica a diferença de 18 s no 3 experimento par 8 segundos no 4 experimento, então Alternativa D 
Observando o primeiro item, números atomicos consecutivos, devem estar um depois do outro, no mesmo período. Assim ficamos com as alternativa A,E. Na letra E os elementos Li, Na e K pertencem à mesma famíia, então tem comportamentos semelhantes e lembre que o bromo, na temperatura ambiente, é liquido, o que não ocorre com o cloro.E o iodo é um sólido altamente volatil em temperatura ambiente.
Importante: na quebra de ligações há absorção de energia e quando as ligações são formadas, há liberação de energia. Isso faz muita diferença no cálculo final da entalpia atraves da quebra e formação de novas substancias.

Se o volume da hemácea aumentou, então “entrou” solvente. Se o volume diminuiu, ” saiu” solvente. Se permaneceu constante, nada ocorreu. Para que o solvente entre é necessaria uma solução menos concentrada- com relação a ela- fora da hemácea.
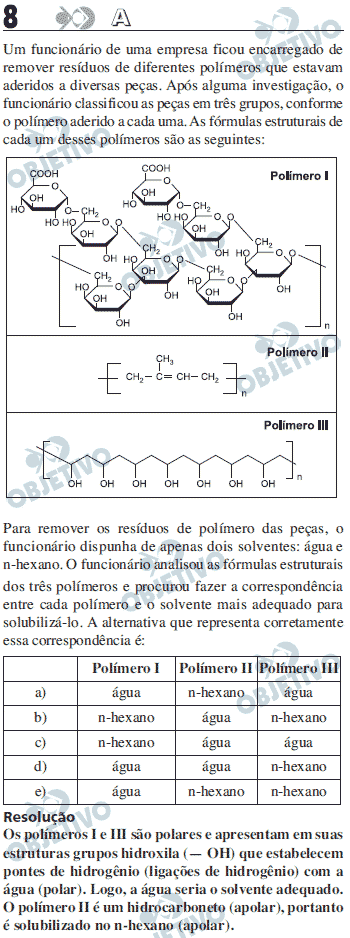
Quanto maior quantidade de ramificações OH, maior a possibilidade de solubilização, o que leva aos polimeros I e III.
O polimero II por ser pouco ramificado e sem OH, solubiliza no n- hexano.

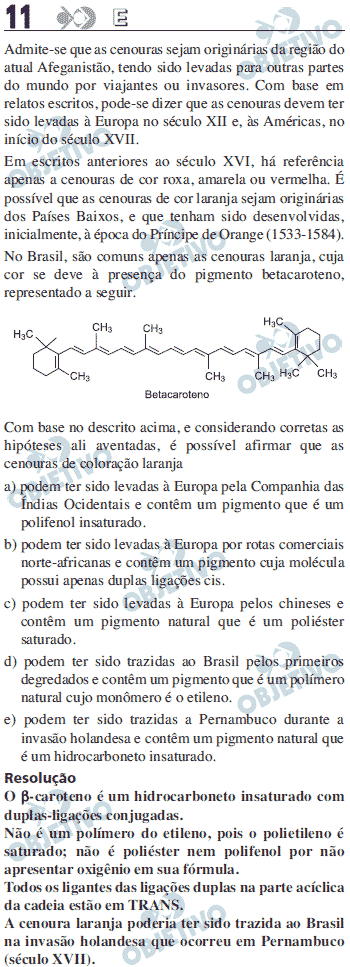
Análise de cadeia- funções presentes:somente hidrocarbonetos ciclicos e não ciclicos, com cadeia ramificada.

