LIGAÇÕES COVALENTES
Na postagem anterior vimos as ligações iônicas e como ocorrem.
|Deu para perceber que, sabendo o número de elétrons na última camada, as ligações acontecem de várias formas.
Na iônica é através de doação de elétrons, lembrando que os átomos desejam ficar com 8 elétrons na última camada ( exceção para o hidrogênio, que fica com 2 elétrons ).
Agora nas ligações covalentes, teremos compartilhamento de elétrons, formando substâncias com propriedades diferentes.
Como Ocorrem as Ligações Covalentes
A ligação covalente ocorre quando dois átomos compartilham pares de elétrons para atingir uma configuração eletrônica estável, geralmente a configuração de gás nobre. Esse compartilhamento permite que ambos os átomos completem seus níveis de energia externos, resultando em uma molécula estável.
- Compartilhamento de Elétrons: Os átomos se unem compartilhando um ou mais pares de elétrons. Por exemplo, na molécula de hidrogênio (H₂), dois átomos de hidrogênio compartilham um par de elétrons.
- Níveis de Energia: O compartilhamento ocorre nos níveis de energia mais externos dos átomos, chamados de camadas de valência.
- Pares de Elétrons: Cada par de elétrons compartilhado é chamado de “par de ligação”. Em alguns casos, podem ser compartilhados dois pares de elétrons (ligação dupla) ou três pares (ligação tripla).
Onde Ocorrem as Ligações Covalentes
As ligações covalentes ocorrem entre não-metais, que têm altas energias de ionização e eletronegatividades comparáveis. Exemplos de onde essas ligações ocorrem incluem:
- Moléculas Diatômicas: Como O₂ (oxigênio) e N₂ (nitrogênio), onde átomos do mesmo elemento se ligam.
- Moléculas Compostas: Como H₂O (água), CO₂ (dióxido de carbono) e CH₄ (metano), onde diferentes elementos químicos formam ligações.
Propriedades das Ligações Covalentes
- Polaridade: As ligações covalentes podem ser polares ou apolares. Ligação polar ocorre quando há uma diferença significativa na eletronegatividade entre os átomos, resultando em uma distribuição desigual de carga. Por exemplo, a água (H₂O) tem ligações polares. Em contraste, uma ligação apolar ocorre entre átomos com eletronegatividades semelhantes, como na molécula de oxigênio (O₂).
- Força de Ligação: As ligações covalentes podem variar em força. Ligações simples são mais fracas do que ligações duplas e triplas.
- Comprimento da Ligação: Geralmente, ligações triplas são mais curtas e mais fortes do que ligações duplas, que são mais curtas e mais fortes do que ligações simples.
- Estado Físico e Ponto de Fusão: Moléculas com ligações covalentes geralmente têm pontos de fusão e ebulição mais baixos do que compostos iônicos e podem ser gases, líquidos ou sólidos em temperatura ambiente.
Exemplos de Ligações Covalentes
- Água (H₂O): Cada átomo de hidrogênio está ligado ao oxigênio por uma ligação covalente simples.
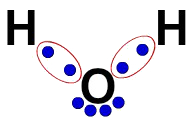
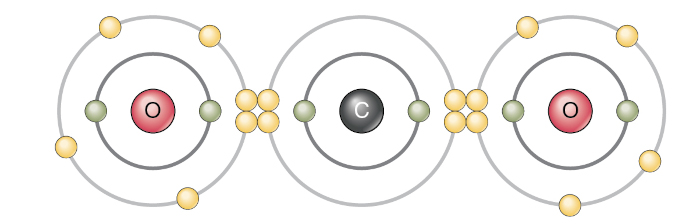
- Dióxido de Carbono (CO₂): O carbono forma duas ligações duplas com dois átomos de oxigênio.
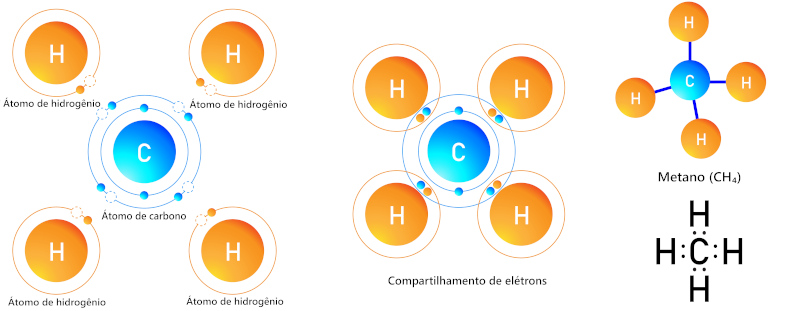
- Metano (CH₄): O carbono forma quatro ligações simples com quatro átomos de hidrogênio.
Importância das Ligações Covalentes
- Compostos Orgânicos: São a base da química orgânica e dos compostos biológicos, como proteínas, ácidos nucleicos e carboidratos.
- Propriedades Físicas e Químicas: Determinam as propriedades de muitos materiais e substâncias, como solubilidade, ponto de fusão e condutividade.
- Reações Químicas: Participam em uma ampla gama de reações químicas, desde a fotossíntese até a respiração celular.
COMO AS FÓRMULAS DAS MOLÉCULAS FORMADAS SÃO REPRESENTADAS:
As fórmulas químicas que representam ligações covalentes podem ser exibidas de várias maneiras, cada uma fornecendo diferentes níveis de detalhe sobre a estrutura da molécula. Aqui estão os principais tipos de representação:
1. Fórmula Molecular
A fórmula molecular mostra a composição de uma molécula indicando o número exato de átomos de cada elemento. Não revela a estrutura ou a forma como os átomos estão conectados.
- Exemplo: A fórmula molecular da água é H2O, indicando que a molécula é composta por dois átomos de hidrogênio e um átomo de oxigênio.
2. Fórmula Estrutural ou Fórmula de Ligação
A fórmula estrutural mostra a disposição dos átomos e as ligações covalentes entre eles. Pode ser desenhada de diferentes maneiras:
- Fórmula de Ligações Simples: Mostra as ligações covalentes entre os átomos com linhas. Cada linha representa um par de elétrons compartilhado (uma ligação simples).
- Exemplo: Para a água, a fórmula estrutural é: H-O-H
- Fórmula de Linhas: Utiliza linhas para representar ligações e é frequentemente usada para moléculas orgânicas. Os átomos de carbono são implícitos e não mostrados explicitamente a menos que haja uma necessidade específica.
- Exemplo: A fórmula estrutural de uma molécula de etano (C2H6) pode ser desenhada como:
- H3C-CH3
3. Fórmula de Lewis ou Estrutura de Lewis
A estrutura de Lewis mostra todos os pares de elétrons compartilhados e não compartilhados (pares solitários) ao redor dos átomos. É útil para visualizar a distribuição dos elétrons e as ligações covalentes.
- Exemplo: A estrutura de Lewis da água é representada como:

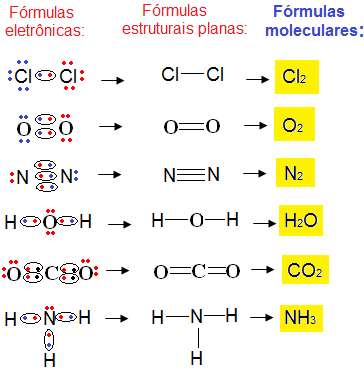
OUTROS EXEMPLOS DE FÓRMULAS DE LEWIS :
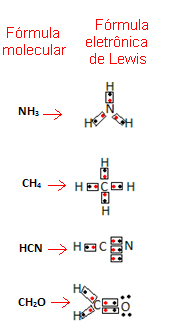
RESUMO:
E A COVALENTE DATIVA?
Um tipo especial de ligação covalente, a ligação covalente dativa, também chamada de ligação covalente coordenada.
Essa ligação também ocorre com o compartilhamento de pares de elétrons, porém, a diferença é que, na ligação covalente normal, os elétrons são provenientes dos átomos dos dois elementos, já na ligação covalente dativa, os elétrons são provenientes somente de um dos átomos.
SO2: Dióxido de enxofre (gás sulfuroso):
O oxigênio e o enxofre são ambos da família 16, o que significa que eles possuem seis elétrons na camada de valência e precisam receber mais dois elétrons (segundo a regra do octeto) para ficar estáveis. Observe a seguir que primeiro o enxofre liga-se a um dos átomos de oxigênio, realizando duas ligações covalentes normais, ou seja, compartilham dois pares de elétrons, ficando ambos estáveis:
![]()
Formação da ligação covalente normal entre o oxigênio e o enxofre
No entanto, ainda temos o outro oxigênio que não está estável e também precisa receber dois elétrons. O enxofre, que é o elemento central, possui dois pares de elétrons disponíveis, assim ele cede um de seus pares para o oxigênio por meio de uma ligação covalente dativa, que é indicada por uma seta que vai em direção ao átomo que utiliza o par eletrônico do outro:


