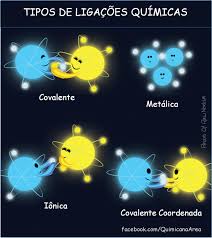
LIGAÇÕES QUÍMICAS
Nas postagens anteriores vimos que os átomos formam moléculas e essas formam as substancias.
Mas, como essas moléculas são formadas?
Como os átomos se ligam entre si, formando todas as substancias que conhecemos?
Todos os átomos da tabela periódica, todos elementos, já estão aqui, nas postagens anteriores.
REGRAS SIMPLES USANDO A TABELA PERÍODICA:
As famílias :
1A- tendência a doar 1 elétron
2A- tendência a doar 2 elétrons
3A- tendência a doar 3 elétrons
E por que isso ocorre?
Todo átomo deseja a estabilidade. E essa estabilidade é conseguida quando ele fica com a configuração de um gás nobre: 8 elétrons na última camada. A exceção é o hélio, que adquire a estabilidade com 2 elétrons na última camada. Essa ligação é chamada iônica.
Quando os átomos não estão nessas famílias citadas, a ligação ocorre , mas de maneira diferente, com o compartilhamento de elétrons, como está explicado abaixo, na ligação covalente.
Então, todos os átomos ficam à procura de ligações para a estabilidade.
E essas ligações entre eles, formam as substancias que conhecemos.
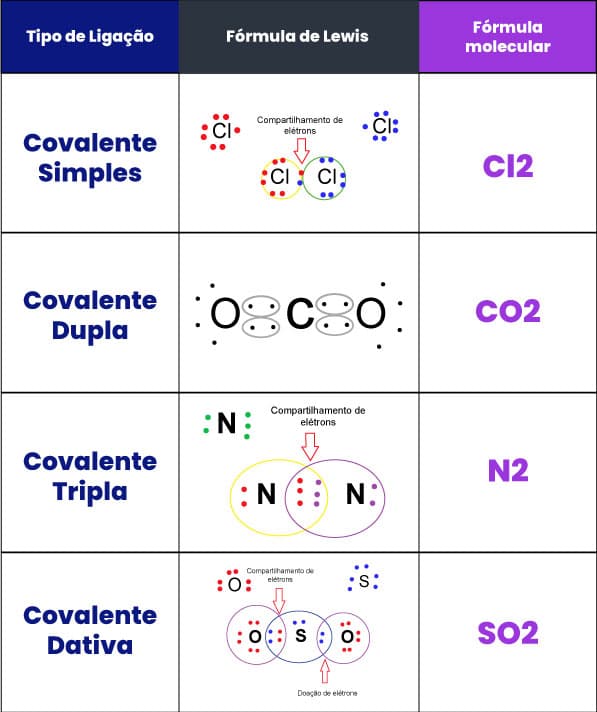
1. Ligação Covalente
Definição: A ligação covalente ocorre quando dois átomos compartilham um ou mais pares de elétrons para atingir uma configuração eletrônica estável.
Como ocorre:
- Formação: A ligação covalente se forma quando dois átomos, que geralmente são não metálicos, se aproximam e compartilham pares de elétrons. Cada átomo contribui com um elétron para o par compartilhado.
- Exemplo: Na molécula de água (H₂O), o oxigênio forma ligações covalentes com dois átomos de hidrogênio. Cada ligação é formada pelo compartilhamento de um par de elétrons entre o oxigênio e o hidrogênio.
Tipos de Ligações Covalentes:
- Simples: Compartilhamento de um par de elétrons (exemplo: H₂).
- Dupla: Compartilhamento de dois pares de elétrons (exemplo: O₂).
- Tripla: Compartilhamento de três pares de elétrons (exemplo: N₂).
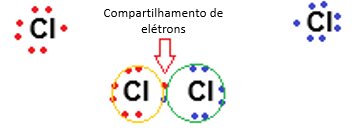
Características:
- Polaridade: Se os átomos envolvidos têm diferentes eletronegatividades, a ligação pode ser polar, com uma distribuição desigual dos elétrons compartilhados (exemplo: H₂O). Se os átomos têm eletronegatividades semelhantes, a ligação é apolar (exemplo: H₂).
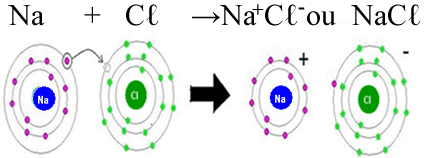
2. Ligação Iônica
Definição: A ligação iônica ocorre quando um átomo doa um ou mais elétrons para outro átomo, resultando na formação de íons positivos e negativos que se atraem devido à força eletrostática.
Como ocorre:
- Formação: Um átomo, geralmente um metal, perde um ou mais elétrons para se tornar um íon positivo (cátion). Outro átomo, geralmente um não-metal, ganha esses elétrons para se tornar um íon negativo (ânion). A atração eletrostática entre esses íons opostos forma a ligação iônica.
- Exemplo: Na formação do cloreto de sódio (NaCl), o sódio (Na) doa um elétron ao cloro (Cl), formando Na⁺ e Cl⁻. A força de atração entre Na⁺ e Cl⁻ mantém os íons unidos na estrutura do sal.
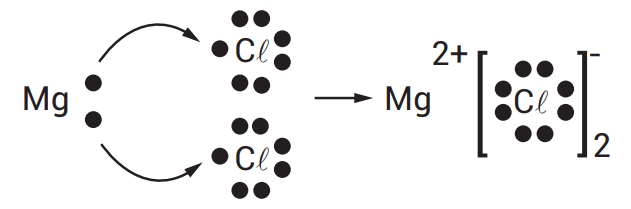
Características:
- Ponto de fusão e ebulição: Geralmente altos, devido às fortes forças de atração entre os íons.
- Condutividade: Soluções aquosas ou fundidas de compostos iônicos conduzem eletricidade devido à mobilidade dos íons.
3. Ligação Metálica
Definição: A ligação metálica ocorre entre átomos de metais, onde os elétrons são compartilhados em uma “nuvem” comum que se move livremente ao redor dos átomos metálicos.
Como ocorre:
- Formação: Em um metal, os átomos do metal liberam seus elétrons de valência, que se tornam elétrons livres. Esses elétrons se movem através de uma estrutura de cátions metálicos (átomos do metal que perderam seus elétrons). A atração entre os cátions e os elétrons livres mantém a estrutura metálica unida.
- Exemplo: O ferro (Fe) é um metal onde os átomos estão dispostos em uma estrutura cristalina, e os elétrons livres se movem por toda a estrutura, permitindo a condutividade elétrica e térmica do metal.
Características:
- Ductilidade e maleabilidade: Os metais são geralmente dúcteis e maleáveis devido à capacidade dos átomos de deslizar uns sobre os outros sem quebrar a estrutura metálica.
- Condutividade: Os metais conduzem eletricidade e calor devido à mobilidade dos elétrons livres.
IMPORTANTE- AS LIGAS METÁLICAS
Ligas Metálicas: Definição, Formação e Principais Exemplos
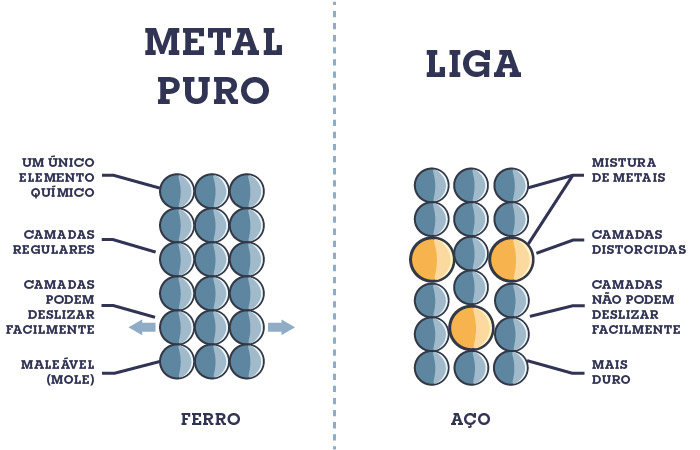
Definição: Ligas metálicas são combinações de dois ou mais elementos, dos quais pelo menos um é um metal. Essas combinações resultam em materiais que possuem propriedades metálicas e são geralmente criadas para melhorar as características físicas e mecânicas dos metais puros, como dureza, resistência à corrosão e ponto de fusão.
Como se Formam: As ligas metálicas se formam quando dois ou mais metais são misturados em estado líquido e depois solidificados. Durante esse processo, os átomos dos metais diferentes se misturam e se organizam em uma estrutura cristalina complexa. O processo de formação de ligas geralmente envolve:
- Fusão: Os metais são aquecidos até se fundirem em um estado líquido.
- Mistura: Os metais fundidos são misturados para que os átomos de diferentes metais se combinem de maneira homogênea.
- Solidificação: A mistura é então resfriada, solidificando-se em uma nova estrutura cristalina que possui propriedades diferentes das dos metais individuais.
Principais Ligas Metálicas:
- Aço:
- Composição: Ferro (Fe) e carbono (C), com possíveis adições de outros elementos como cromo, níquel e molibdênio.
- Propriedades: Alta resistência, dureza, e ductilidade. O aço é amplamente utilizado em construção civil, fabricação de veículos e ferramentas.
- Tipos: Existem muitos tipos de aço, como o aço carbono, aço inoxidável e aço ferramenta, cada um com propriedades específicas adaptadas a diferentes aplicações.
-

aço usado na construção civil- imagem: Udiaço
- Bronze:
- Composição: Principalmente cobre (Cu) e estanho (Sn), com outras possíveis adições como fósforo, alumínio ou manganês.
- Propriedades: Alta resistência ao desgaste e à corrosão, além de uma boa fusibilidade e trabalhabilidade. O bronze é utilizado para fabricar moedas, estatuetas e componentes de máquinas.
-

bronze- liga metálica – objetos de bronze- imagem: Vestibulando Web
- Latão:
- Composição: Cobre (Cu) e zinco (Zn). A proporção de zinco pode variar, resultando em diferentes tipos de latão com propriedades variadas.
- Propriedades: Boa resistência à corrosão, ductilidade e facilidade de usinagem. É usado em instrumentos musicais, torneiras e peças decorativas.
-

instrumento musical feito de latão – imagem: Coopermetal
- Alumínio-Lítio:
- Composição: Alumínio (Al) e lítio (Li), com adições de outros elementos como cobre ou manganês.
- Propriedades: Reduz o peso e melhora a resistência à corrosão e a resistência mecânica. Usado em aplicações aeroespaciais e em componentes de alta performance onde a redução de peso é crucial.
-

liga de alumínio e lítio – imagem: HNOSC
- Níquel-Cromo:
- Composição: Níquel (Ni) e cromo (Cr), com possíveis adições de outros elementos como molibdênio.
- Propriedades: Alta resistência à corrosão e ao desgaste, e boa capacidade de suportar altas temperaturas. Comumente utilizado em elementos de aquecimento e componentes de motores.
-

resistência de níquel- cromo – imagem: Corel resistências elétricas
- Zinco-Alumínio (ZAMAK):
- Composição: Zinco (Zn), alumínio (Al), magnésio (Mg) e cobre (Cu).
- Propriedades: Boa fluidez e resistência ao desgaste. Usado em peças fundidas e em componentes industriais.
-

Porcas Borboleta em Zamak-ROSCAS EM POLEGADA (UNC OU WW) imagem: – Paulufusos –
Características Gerais das Ligas Metálicas:
- Propriedades Mecânicas: As ligas geralmente possuem propriedades mecânicas superiores às dos metais puros, como maior dureza e resistência.
- Condutividade: A condutividade elétrica e térmica das ligas pode ser alterada em comparação com os metais puros.
- Resistência à Corrosão: Algumas ligas são projetadas para oferecer maior resistência à corrosão em ambientes agressivos.
As ligas metálicas desempenham um papel crucial em muitas indústrias e aplicações tecnológicas, devido às suas propriedades otimizadas e à capacidade de serem adaptadas para atender a necessidades específicas.