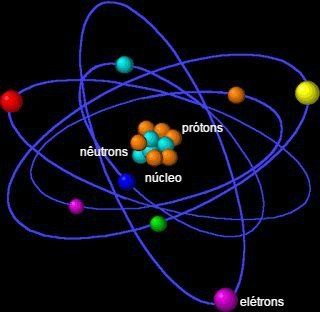
NÚMERO ATÔMICO, NÚMERO DE MASSA EM ÁTOMOS E ÍONS
Através das postagens anteriores, você acompanhou a construção da tabela periódica e todos os seus elementos.
Agora vamos ver qual o significado dos números que aparecem junto de cada elemento químico.
E as informações que podemos obter com eles.
1. Número Atômico
Definição: O número atômico (representado por Z) é o número de prótons presentes no núcleo de um átomo. Ele é um dos principais identificadores de um elemento químico, pois define a identidade do elemento.
Propriedades:
- Identidade Química: O número atômico determina qual elemento químico o átomo representa. Por exemplo, o número atômico 6 corresponde ao carbono (C), 8 corresponde ao oxigênio (O), etc.
- Número de Elétrons: Em um átomo neutro, o número de elétrons é igual ao número de prótons, assim o número atômico também indica o número de elétrons em um átomo neutro.
2. Número de Massa
Definição: O número de massa (representado por A) é a soma do número de prótons e nêutrons no núcleo de um átomo. Ele fornece uma indicação da massa total do núcleo do átomo.
Fórmula: A=Z+N e é o número de nêutrons.( os nêutrons ficam dentro do núcleo do átomo, junto com os prótons. São eles que dão a coesão do núcleo, uma vez que não tem carga, e os prótons são positivos ( o que poderia acarretar em repulsão elétrica)
Propriedades:
- Massa Atômica: O número de massa não é diretamente a massa do átomo em unidades de massa atômica (u), mas dá uma ideia geral da massa relativa do núcleo.
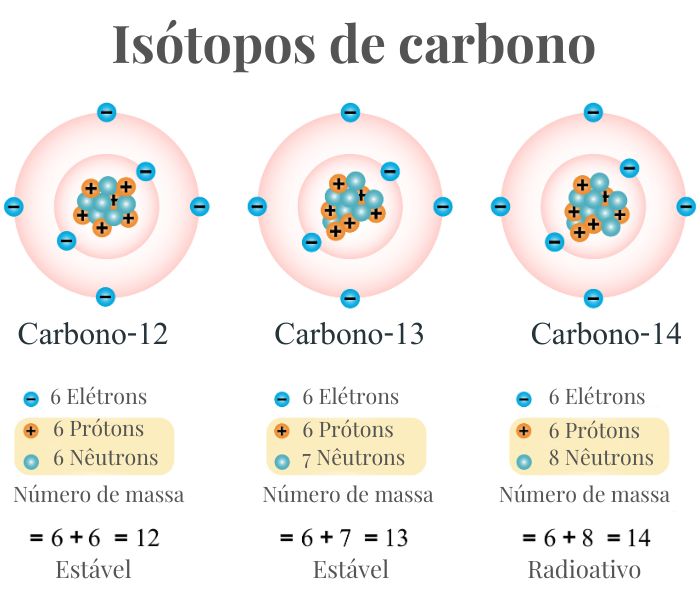
- Isótopos: Átomos do mesmo elemento químico podem ter diferentes números de massa devido a diferentes quantidades de nêutrons. Estes são chamados de isótopos. Por exemplo, o carbono pode ter isótopos com números de massa 12 e 14 (C-12 e C-14).
3. Átomo vs. Íon
Átomo:
- Definição: Um átomo é uma unidade básica da matéria que tem um número igual de prótons e elétrons, resultando em uma carga elétrica líquida neutra.
- Número Atômico e Massa: Em um átomo neutro, o número de prótons é igual ao número de elétrons, e o número de massa é a soma dos prótons e nêutrons.
Íon:
- Definição: Um íon é um átomo que perdeu ou ganhou um ou mais elétrons, resultando em uma carga elétrica líquida positiva ou negativa.
- Cátions: Íons positivos que ocorrem quando um átomo perde elétrons. Por exemplo, um átomo de sódio (Na) pode perder um elétron para se tornar um cátion Na⁺.
- Ânions: Íons negativos que ocorrem quando um átomo ganha elétrons. Por exemplo, um átomo de cloro (Cl) pode ganhar um elétron para se tornar um ânion Cl⁻.
Propriedades dos Íons:
- Número Atômico: O número atômico do íon é o mesmo do átomo neutro, pois o número de prótons não muda.
- Número de Massa: O número de massa também permanece o mesmo, pois a perda ou ganho de elétrons não afeta o número de prótons e nêutrons no núcleo.
- Carga Elétrica: A carga do íon é determinada pelo número de elétrons em relação ao número de prótons. Um íon positivo (cátion) tem menos elétrons que prótons, enquanto um íon negativo (ânion) tem mais elétrons que prótons.
Exemplo Prático:
- Átomo de Carbono (Neutro):
- Número Atômico (Z): 6 (6 prótons e 6 elétrons)
- Número de Massa (A) : 12 (6 prótons + 6 nêutrons)
- Simbolismo: 6 C 12
- Íon de Carbono (Cátion Carbono-4):
- Se um átomo de carbono perde 4 elétrons, ele se torna um cátion com carga +4 (C⁴⁺).
- Número Atômico (Z): 6 (ainda 6 prótons)
- Número de Massa (A): 12 (ainda 6 prótons + 6 nêutrons)
Lembre que o número de massa sempre estará em cima do símbolo do elemento, em qualquer exercício que você fizer.
MAS NA TABELA PERÍODICA, ESSE NÚMERO ESTÁ EMBAIXO, POIS A TABELA FOI CONSTRUIDA ATENDENDO AO NÚMERO ATÔMICO CRESCENTE.
SEMELHANÇAS ATÔMICAS:
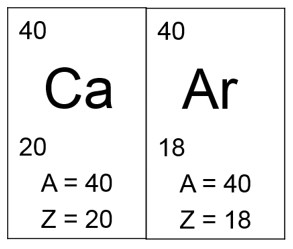
1. Isóbaros
Definição: Isóbaros são átomos ou núcleos que têm o mesmo número de massa (número de prótons mais o número de nêutrons), mas diferentes números atômicos (número de prótons) e, portanto, são diferentes elementos químicos.
Exemplo:
- Cálcio-40 (Ca-40) e Argônio-40 (Ar-40) são isóbaros. Ambos têm um número de massa igual a 40.
- Cálcio-40: Número atômico = 20, Número de nêutrons = 20 (40 – 20).
- Argônio-40: Número atômico = 18, Número de nêutrons = 22 (40 – 18).
Esses elementos são diferentes em termos de química e propriedades físicas, mas têm o mesmo número de massa.
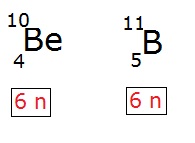
2. Isótonos
Definição: Isótonos são átomos ou núcleos que têm o mesmo número de nêutrons, mas diferentes números atômicos (número de prótons) e, portanto, diferentes números de massa e diferentes elementos químicos.
Exemplo:
- Carbono-14 (C-14) e Nitrogênio-15 (N-15) são isótonos. Ambos têm 8 nêutrons.
- Carbono-14: Número atômico = 6, Número de nêutrons = 8 (14 – 6).
- Nitrogênio-15: Número atômico = 7, Número de nêutrons = 8 (15 – 7).
Apesar de terem o mesmo número de nêutrons, esses núcleos são diferentes elementos químicos.
3. Isoeletrônicos
Definição: Isoeletrônicos são átomos, íons ou moléculas que têm o mesmo número de elétrons e, portanto, a mesma configuração eletrônica, embora possam ter diferentes números atômicos ou cargas.
Exemplo:
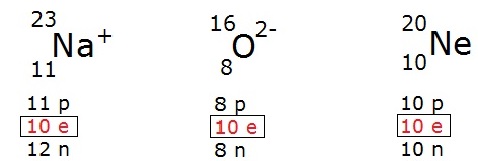
- Íon Sódio (Na⁺), Íon Magnésio (Mg²⁺) e Átomo Neônio (Ne) são isoeletrônicos.
- Na⁺: Número atômico = 11, tem 10 elétrons (perdeu 1 elétron).
- Mg²⁺: Número atômico = 12, tem 10 elétrons (perdeu 2 elétrons).
- Ne: Número atômico = 10, tem 10 elétrons (átomo neutro).
Todos esses têm 10 elétrons e, portanto, a mesma configuração eletrônica, que é a configuração do gás nobre Neônio (1s² 2s² 2p⁶).
Resumo dos Conceitos:
- Isóbaros: Mesma massa atômica, diferentes números atômicos. Exemplo: Ca-40 e Ar-40.
- Isótonos: Mesmo número de nêutrons, diferentes números atômicos e massa. Exemplo: C-14 e N-15. Outro exemplo:
- Isoeletrônicos: Mesmo número de elétrons, diferentes números atômicos e cargas. Exemplo: Na⁺, Mg²⁺ e Ne.
- Isótopos: Mesmo número atômico, diferente número de massa ( mesmo número de prótons, diferente número de nêutrons) mesmo número de elétrons .O carbono pode ter isótopos com números de massa 12 e 14 (C-12 e C-14).
REPRESENTAÇÃO DE UM ÁTOMO: