ALÔ PESSOAL!!!!
Entrando em assunto novo, vamos de oxidação e redução, lembrando os conceitos fundamentais:
Oxidação é o processo químico onde há perda de elétrons.
Dessa forma o número de oxidação aumenta.
Ex: Cu (s) ——> Cu +2 + 2 e –
nessa reação o cobre ( metal ) oxidou, perdendo dois elétrons e tornando-se íon cobre positivo.
No cobre metal o número de oxidação é zero. No íon cobre o numero de oxidação é +2.
Redução é o processo químico onde há ganho de elétrons, diminuindo o número de oxida
ção.
Ex: Ag +1 + 1 e- —-> Ag
nessa reação a prata ( íon) reduziu, ganhando um elétron e se tornando o metal prata .
No íon prata o número de oxidação é +1. No metal prata o número de oxidação é zero.
Agente redutor é a espécie química que contém o elemento que se oxida , no caso acima o agente redutor é o cobre.
Agente oxidante é a espécie química que contém o elemento que se reduz, no caso acima o agente oxidante é a prata.
As reações de oxidação e redução ocorrem juntas, sempre uma espécie vai perder elétrons e a outra vai adquiri-los.
Chamamos isso de reações de óxido redução.
Outro exemplo: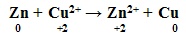

Na prática como isso ocorre:
Uma barra de zinco é colocada em uma solução de cobre: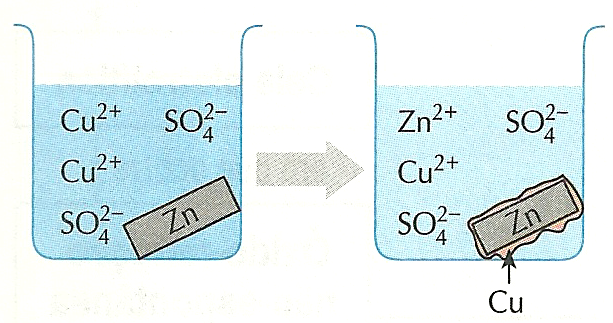
o que ocorre?
o zinco se oxida , se “desfaz” e uma camada de cobre metálico começa a envolver a placa restante de zinco.
QUER POSTAGENS? QUER VÍDEOS?QUER ATUALIDADES? AQUI TEM TUDO ! PROF° LÍGIA LOBO
