pH e pOH
O pH e o pOH são medidas relacionadas à acidez e alcalinidade de uma solução, fundamentais na química e em várias aplicações.
Definições
- pH (potencial hidrogénio) :
- Mede a concentração de íons de hidrogênio (H+ ou H3O+ ) numa solução.
- Uma escala logarítmica é usada para determinar se uma solução é ácida, neutra ou alcalina.
- Intervalo de medição: 0 a 14 (embora possa haver valores para esse intervalo em soluções extremas).
- Escala de pH :
- : Solução ácida.
- : Solução neutra.
- : Solução alcalina (básica).
- pOH :
- Mede a concentração de íons hidróxido ( ) numa solução.
- Também utiliza uma escala logarítmica
- : Solução alcalina.
- p: Solução neutra.
- : Solução ácida.
- Relação entre pH e pOH :
Fórmulas
- Cálculo do pH :
- Cálculo do pOH :
- Concentração dos íons H+ e OH-
- Produto iônico de água:
Aplicações
- Química Analítica :
- Determinação de propriedades ácido-base de soluções.
- Títulos ácido-base para descobrir concentrações desconhecidas.
- Indústria :
- Monitorização do pH na produção de alimentos, bebidas e cosméticos.
- Tratamento de águas (controle de pH em esgotos e piscinas).
- Saúde :
- Medição do pH sanguíneo (manutenção entre 7,35 e 7,45 para a homeostasia).
- Testes de pH na urina para avaliar condições metabólicas.
- Agricultura :
- Determinação do pH do solo para melhoria do crescimento das plantas.
- Laboratórios :
- Controle do pH em culturas microbiológicas e reações bioquímicas.
Utilizações Práticas
- Indicadores de pH :
- Substâncias que mudam de cor dependendo do pH (ex.: fenolftaleína, papel de tornassol).
- pH-metros :
- Equipamentos eletrônicos para precisão de pH.
- Cálculo de diluições :
- Ajuste do pH em soluções diluídas ou equipamentos para processos industriais ou laboratoriais.
-
Efeitos e Importância do pH em Contextos Reais
- Ecologia e Meio Ambiente :
- Água potável : O pH deve estar entre 6,5 e 8,5 para evitar corrosão ou crescimento microbiano.
- Lagos e rios : Alterações no pH podem ser fatais para aquários. Por exemplo, chuva ácida com é prejudicial.
- Medicina :
- O equilíbrio ácido-base no corpo humano é mantido principalmente pelos sistemas orgânicos, como o bicarbonato.
- Alterações no pH do sangue (acidose ou alcalose) podem indicar doenças graves.
- Indústria Alimentar :
- O pH controla o sabor, conservação e segurança alimentar.
- Exemplo: A fermentação de iogurtes reduz o pH, ou que inibe o crescimento de patógenos.
- Produtos de Higiene e Cosméticos :
- As fórmulas são ajustadas para ter um pH compatível com a pele (pH ~5,5).
- Sistemas Agrícolas :
- O pH do solo depende da disponibilidade de nutrientes para as plantas.
- Solos agressivos () podem exigir adição de cálcio (CaCO3) para neutralizar.
RESUMO:
- Ecologia e Meio Ambiente :
-
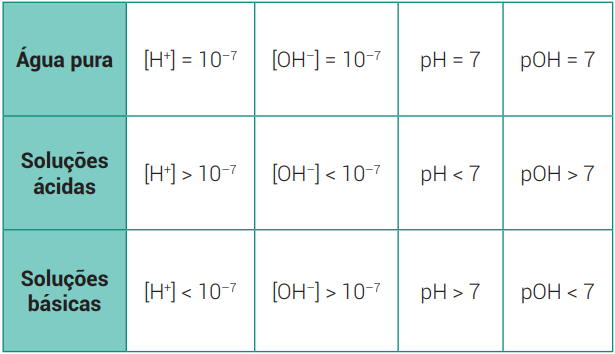
Resumo de pH e p OH para as soluções ácidas e básicas. imagem: https://proenem.com.br/ - EXERCÍCIOS:
- EXERCÍCIOS RESOLVIDOS
01. (UFPE) A concentração hidrogeniônica do suco de limão puro é 10⁻³ mol/L. Qual o pH de um refresco preparado com 20 mL de suco de limão e água suficiente para completar 200 mL?
a) 2,5
b) 3,0
c) 3,5
d) 4,0
e) 4,5Resolução: D
Como foi feita uma diluição (aumento do volume de solvente), a concentração de íons H+ diminuiu, e precisa ser calculada antes da determinação do pH:M¹ . V¹ = M² . V²
10⁻³ . 20 = M² . 200
M² = 10⁻⁴ mol/L
Aplicando na relação [H+] = 10⁻ᵖᴴ, tem-se que:
10⁻⁴ = 10⁻ᵖᴴ
ph = 4
02. Uma solução de hidróxido de sódio foi preparada pela dissolução de 0,040 g de NaOH em água destilada, obtendo-se 100mL como volume final da mistura homogênea.
Considerando a massa molar do hidróxido de sódio igual a 40 g . mol⁻¹, pode-se inferir que o pH da solução final é igual a:
a) pH = 2
b) pH = 7
c) pH = 9
d) pH = 11
e) pH = 14Resolução: D
Como a concentração é em mol/L, é necessário converter o volume de mililitro para litro, ou seja, V = 100 mL = 0,1 L.
Assim:M = m/MM.V
M = 0,040/40 . 0,1
M = 10⁻³ mol/L
A equação que representa a dissociação do hidróxido de potássio é:
NaOH → Na+ + OH
Como a proporção é 1:1 (1 mol de base para 1 mol de íons hidroxila), tem-se que:
[OH-] = 10⁻³ M
[OH-] 10⁻ᵖᴼᴴ = 10⁻³
pOH = 3
Como pH + pOH = 14, tem-se que:
pH + 3 = 14
pH = 11 - ( https://proenem.com.br/)
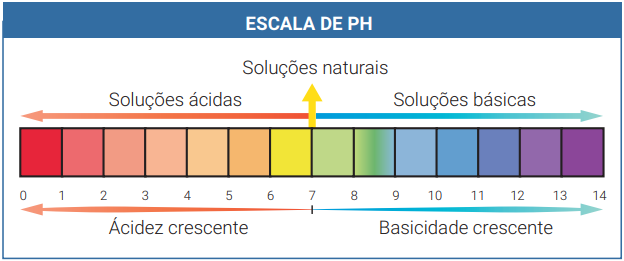
ESCALA DE pH:
INDICADORES:
São substancias que identificam se a solução é ácida ou básica:


EXEMPLOS:
.jpg)

