PILHAS
As pilhas são dispositivos que convertem energia química em energia elétrica por meio de reações eletroquímicas. Elas consistem em dois eletrodos (ânodo e cátodo) e um eletrólito. Quando a pilha é conectada a um circuito, ocorre uma reação química que libera elétrons, gerando uma corrente elétrica.
AQUI, BEM EXPLICADA, A PILHA DE DANIELL
Reações que Ocorrem:
1. Reação de Oxidação: No ânodo, ocorre a oxidação, onde um material perde elétrons.
A oxidação ocorre quando uma espécie perde elétrons e se transforma em um cátion: A → A+ + e–.
2. Reação de Redução: No cátodo, ocorre a redução, onde um material ganha elétrons.
A redução ocorre quando uma espécie ganha elétrons e se torna eletricamente neutra: B+ + e– → B.
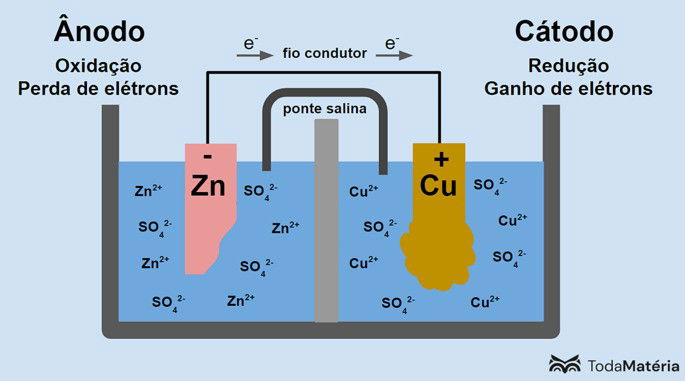
3. Eletrólito: O eletrólito permite a movimentação de íons entre os eletrodos, completando o circuito e permitindo que a corrente flua.
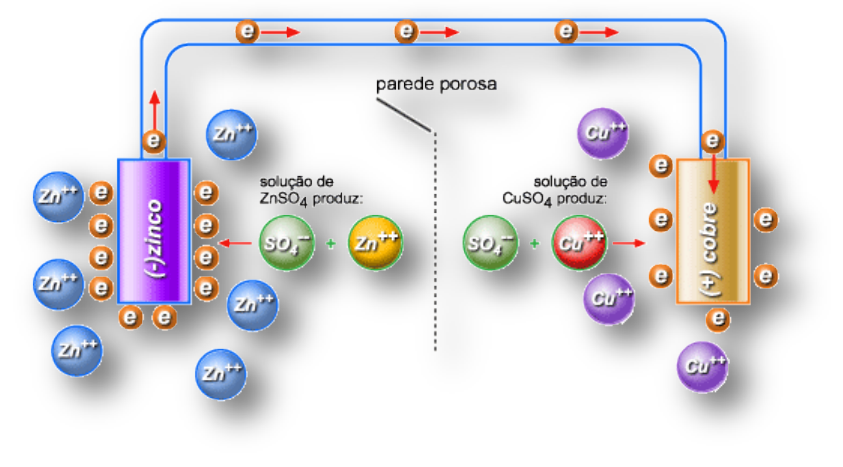
Observe o desenho acima:
Solução de ZnSO4 e uma placa de zinco. Veja o desgaste na placa. Isso ocorre porque os elétrons que formam o zinco ( todo metal tem um mar de elétrons livres ao seu redor) são “sugados” pelo cobre.
Quando chegam na placa de cobre (Cu) que está mergulhada em uma solução de CuSO4 , esses elétrons se juntam ao Cu+2 da solução e forma cobre metálico que se agrega à placa, aumentando seu tamanho.
Tem o fio condutor para que esses elétrons possam passar e a ponte salina para equilibrar ( sem ela não ocorre reação)
Então as reações que ocorrem são:
OXIDAÇÃO- ONDE HÁ O DESGASTE : ÂNODO POLO NEGATIVO DA PILHA
Zn ⇒ Zn+2 + 2 e- ( os elétrons caminham em direção ao cobre e os cátions Zn+2 vão para a solução que se torna mais concentrada )
REDUÇÃO – ONDE HÁ O AUMENTO DA PLACA- CÁTODO POLO POSITIVO DA PILHA
Cu+2 + 2e- ⇒ Cu ( s) ( os elétrons caminham pela placa e se juntam aos íons cobre dissolvidos na solução. Essa se torna mais diluída)
EQUAÇÃO GERAL DA PILHA:
Zn + Cu+2 ⇒ Zn+2 + Cu(s)
Em uma pilha, a tendência das espécies químicas receberem ou doarem elétrons é determinada pelo potencial de redução.
O componente com maior potencial de redução tende a sofrer redução, ou seja, ganhar elétrons. A espécie de menor potencial de redução e, consequentemente, maior potencial de oxidação, tende a transferir elétrons.
Por exemplo, na reação de oxirredução Zn0(s) + Cu2+(aq) → Cu0(s) + Zn2+(aq)
O zinco oxida e doa elétrons porque tem potencial de redução E0 = -0,76V, menor que o potencial de redução do cobre E0 = +0,34V e, por isso, este recebe elétrons e sofre redução.( https://www.todamateria.com.br)
Há uma tabela que mostra todos os potenciais de oxidação e redução. Dessa forma é possível prever como será a reação da pilha. Inclusive se ela é possível- espontânea- ou não.

NOX é o número de oxidação de cada elemento, em uma determinada reação:
A função da pilha é fornecer energia através dessa diferença de potencial entre um metam e outro, que provoca o deslocamento dos elétrons, gerando uma corrente elétrica, que pode ser calculada. Essa corrente é a voltagem da pilha. Também chamada de DDP.
CÁLCULO DA VOLTAGEM DA PILHA:
ΔE = Ered (maior) – Ered (menor)
ou
ΔE = Eoxi (maior) – Eoxi (menor)
EXEMPLO:
(UFSC-SP) Dadas as semirreações:
2 Fe+2 → 2 Fe+3 + 2 e E oxi = – 0,77 V
2 Cl-1 → 1 Cl2 + 2 e E oxi = – 1,36 V
Calcule o potencial da reação abaixo (pilha) e diga se ela é espontânea ou não, assinalando a opção correta:
2 Fe+2 + Cl2 → 2 Fe+3 + 2 Cl-1
O exercício pede para determinar o valor do potencial da pilha, basta analisar os potenciais de oxidação fornecidos para julgar qual deles é o maior e qual é o menor:
2 Fe+2 → 2 Fe+3 + 2 e Eoxi = – 0,77 V (Esse é o maior)
2 Cl-1 → 1 Cl2 + 2 e Eoxi = – 1,36 V (Esse é o menor)
Em seguida, basta aplicar na fórmula do cálculo do potencial de uma pilha:
ΔE = Eoxi (maior) – Eoxi (menor)
ΔE = – 0,77 – (-1,36)
ΔE = – 0,77 + 1,36
ΔE = + 0,59 V
Como o potencial encontrado apresenta um valor positivo, temos um processo espontâneo.( exercício retirado do https://brasilescola.uol.com.br )
TIPOS DE PILHAS
1. Pilhas Alcalinas: Comuns em dispositivos eletrônicos, têm uma boa capacidade e longa duração.

2. Pilhas de Lítio: Usadas em eletrônicos portáteis, como celulares, devido à sua alta densidade de energia.

3. Pilhas NiMH (Níquel-Hidreto Metálico): Frequentemente usadas em dispositivos recarregáveis, como câmeras e brinquedos.

4-Pilhas de mercúrio:

UTILIZAÇÕES
As pilhas são amplamente utilizadas em diversos dispositivos, como:
– Eletrônicos Portáteis: Celulares, laptops e tablets.
– Brinquedos: Muitos brinquedos funcionam com pilhas.
– Equipamentos Médicos: Como marcapassos e monitores de glicose.
– Veículos Elétricos: Utilizam pilhas para armazenar energia e alimentar motores.
EXERCÍCIOS:
(PUC) Na cela eletroquímica representada pela equação:
Ni0 + 2Ag+ → Ni2+ + 2Ag0
é correto afirmar que:
a) os elétrons fluem, pelo circuito externo, da prata para o níquel.
b) o cátodo é o eletrodo de níquel.
c) o eletrodo de prata sofre desgaste.
d) a prata sofre redução.
e) a solução de níquel irá se diluir.
resposta:d
A reação global Ni0 + 2Ag+ → Ni2+ + 2Ag0 é formada pelas duas semirreações mostradas a seguir que ocorrem no ânodo e no cátodo da pilha:
ânodo (polo negativo onde ocorre a oxidação ou perda de elétrons): Ni0→ Ni2+ + 2 e–
cátodo (polo positivo onde ocorre a redução ou ganho de elétrons): Ag+ + e– → Ag0
Assim, temos o seguinte:
a) Incorreta. Visto que o níquel perdeu elétrons e a prata ganhou elétrons, os elétrons fluem do níquel para a prata.
b) Incorreta. O cátodo é o eletrodo de prata.
c) Incorreta. Visto que os íons prata recebem elétrons, são formados mais átomos de prata metálica que se depositam sobre o eletrodo de prata. Assim, o eletrodo de prata não sofre desgaste, pelo contrário, sua massa aumenta.
d) Correta. A prata ganhou elétrons, sofrendo redução.
e) Incorreta. Visto que o níquel do eletrodo recebe elétrons e forma mais íons níquel para ficarem na solução, essa solução terá sua concentração aumentada.
Exercício de : https://exercicios.brasilescola.uol.com.br
RECICLAGEM DAS PILHAS E SEU DESCARTE:
As pilhas e baterias de uso doméstico apresentam um grande perigo quando descartadas incorretamente. Na composição dessas pilhas são encontrados metais pesados como: cádmio, chumbo, mercúrio, que são extremamente perigosos à saúde humana. Dentre os males provocados pela contaminação com metais pesados está o câncer e mutações genéticas.
Só para esclarecer, as pilhas e baterias em funcionamento não oferecem riscos, uma vez que o perigo está contido no interior delas. O problema é quando elas são descartadas e passam por deformações na cápsula que as envolvem: amassam, estouram, e deixam vazar o líquido tóxico de seus interiores. Esse líquido se acumula na natureza, ele representa o lixo não biodegradável, ou seja, não é consumido com o passar dos anos. A contaminação envolve o solo e lençóis freáticos prejudicando a agricultura e a hidrografia.
Justamente por serem biocumulativas é que surgiu a necessidade do descarte correto de pilhas e baterias usadas.
O que não pode ser feito é o descarte desses materiais no lixo comum. Já existem leis que obrigam os fabricantes a receberem de volta pilhas e baterias, e desta forma dar a elas o destino adequado. Seria fundamental que também colocassem advertências na própria embalagem do produto, avisando dos eventuais perigos oferecidos pelo descarte incorreto do material.
O que você consumidor pode fazer? O ideal é separar o lixo tóxico do restante, dessa forma você facilita a coleta e posterior armazenagem em aterros especiais. Mas se optar pelo envio ao fabricante, estará alertando-o de sua preocupação e, quem sabe dessa forma, ele tome consciência de sua responsabilidade como produtor e dê destino correto ao seu produto após o uso.( https://mundoeducacao.uol.com.br/)
Como é feita a reciclagem de pilhas e baterias ( Recicla Sampa)
É importante saber que existem processos de reciclagem que são apropriados para apenas um tipo de pilhas. Por isso, é necessária uma classificação inicial. Há, também, outros métodos que podem realizar o tratamento de todos os tipos de pilhas misturados, que exige um maior número de etapas no tratamento.
Normalmente, as operações realizadas são: separação, trituração, filtragem, teste químico e tratamento térmico.
Separação
O primeiro passo é separar as pilhas e baterias por tipo (celular, carro etc.). As pilhas comuns são abertas e suas capas plásticas são retiradas, separando-se do miolo metálico. O plástico é encaminhado para reciclagem especializada.
Trituração
A parte metálica é triturada até virar pó. Este pó, então, é tratado quimicamente até seu pH ser neutralizado. Assim, deixa de reagir e ser tóxico ao meio ambiente.
Filtragem
Depois, o pó segue para um filtro do tipo prensa, que separa a parte líquida (que segue para uma estação de tratamento) da sólida.
Teste químico
O material passa, então, por um teste químico para revelar qual metal está mais abundante em sua composição. Isso definirá qual será a cor do produto final.
Tratamento térmico
A mistura vai para aquecimento em um forno a mais de 1.300 Cº. Ela se transforma em um óxido metálico em pó, neutralizado e, portanto, inofensivo ao meio ambiente e à saúde que pode ser usado, por exemplo, como corante para a fabricação de cerâmicas, vidros, fogos de artifício, pisos e azulejos.

