RADIOATIVIDADE
Uma reação nuclear é diferente de uma reação química. Em transformações nucleares o núcleo do átomo sofre alterações, já as reações químicas ocorrem na eletrosfera do átomo.
Breve Histórico da Radioatividade
- Descoberta : Em 1896, o físico francês Henri Becquerel descobriu a radioatividade ao observar que sais de urânio emitiam radiação espontaneamente, capaz de impressionar chapas fotográficas.
- Marie e Pierre Curie : Em 1898, o casal Curie isolou os elementos rádio e polônio, aprofundando os estudos sobre a radioatividade.
- Avanços científicos : No início do século XX, Ernest Rutherford classificou as partículas emitidas como alfa, beta e gama, enquanto outros cientistas instalaram a estrutura do átomo e explicaram o decaimento radioativo.
Princípios da Radioatividade
- Decaimento Nuclear : Átomos instáveis (radionuclídeos) emitem radiação para alcançar uma configuração energética mais estável.
- Emissões Radioativas :
- Partículas Alfa (α) : Núcleos de hélio (2 prótons e 2 nêutrons), de grande massa e baixa escuridão.
- Partículas Beta (β) : Elétrons ou pósitrons emitidos em alta velocidade, com maior penetração que as partículas alfa.
- Radiação Gama (γ) : Ondas eletromagnéticas altamente penetrantes.
| Nome | Símbolo | Carga elétrica | Natureza | Poder de penetração |
|---|---|---|---|---|
| Alfa | +2 | Formada por dois prótons e dois nêutrons. | pequeno | |
| Beta | -1 | Elétron produzido em transformações nucleares. | médio | |
| Gama | 0 | Radiação eletromagnética. | alto |
3-Meia-Vida : Tempo necessário para que metade dos núcleos instáveis de uma amostra se desintegre.
Aplicações da Radioatividade
- Medicina :
- Radioterapia : Tratamento de câncer com radiação.
- Medicina Nuclear : Uso de radionuclídeos em diagnóstico (ex.: PET Scan).
- Energia Nuclear :
- Produção de eletricidade em reatores nucleares.
- Indústria :
- Controle de qualidade por radiografia industrial.
- Esterilização de alimentos e equipamentos médicos.
- Pesquisa Científica :
- Datação radiométrica (ex.: Carbono-14).
- Defesa :
- Armas nucleares (uso militar devastador).
Perigos da Radiação
- Efeitos Biológicos :
- Doses Baixas : Danos ao DNA, risco de mutações e câncer.
- Altas Doses : Queimaduras, síndrome de radiação aguda, e morte celular massiva.
- Contaminação Ambiental :
- Acidentes nucleares (ex.: Chernobyl, Fukushima) têm impactos duradouros no ambiente e na saúde.
- Resíduos Radioativos :
- Dificuldade de armazenamento seguro e prolongado.
Proteção Contra Radiação
- Tempo : Minimiza o tempo de exposição.
- Distância : Aumentar a distância da fonte radioativa.
- Blindagem : Usar materiais como chumbo ou concreto para bloquear a radiação.
Explicando as radiações alfa, beta e gama : (https://www.todamateria.com.br)
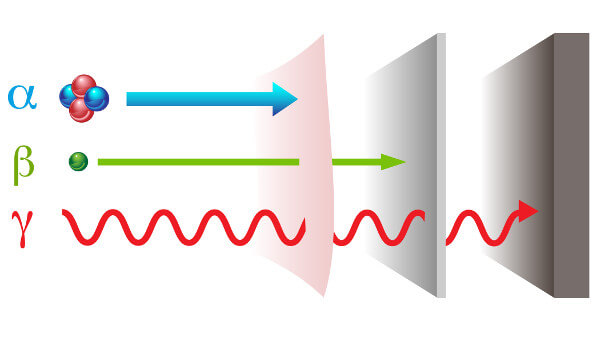
Emissões Alfa 
São partículas pesadas de carga positiva, que possuem carga elétrica +2 e massa igual a 4.
Por possuir 2 prótons e 2 nêutrons, seu núcleo é comparado ao do elemento químico hélio, e por isso, alguns autores também a chamam de “hélion”.
Possui pequeno poder de penetração, e por isso a sua radioatividade pode ser impedida por uma folha de papel.
Emissões Beta 
São partículas leves, de carga negativa e que não contêm massa. O elétron da partícula é produzido por reações nucleares a partir de um nêutron e possui alta velocidade.
Nessa reação, um nêutron instável se desintegra, convertendo-se em um próton, que permanece no núcleo, há a emissão de um elétron em alta velocidade e do neutrino, cuja massa e carga são desprezíveis.
Possui poder de penetração superior a radioatividade alfa, podendo penetrar uma folha de papel, mas não uma placa de metal.
Emissões Gama 
São ondas eletromagnéticas de altíssima frequência e que não possuem massa e carga elétrica.
A sua capacidade de penetração é superior aos raios-X e faz com que a sua radioatividade passe tanto pelo papel como pelo metal.
A radiação gama é bem mais penetrante que os outros dois tipos devido o seu comprimento de onda ser bem menor, podendo facilmente atravessar todo o nosso organismo.
À medida que a radiação é emitida, o átomo se desintegra, o que resulta na sua transformação, pois é o número atômico que determina o elemento químico.
O tempo que essa desintegração do elemento leva para reduzir a sua massa pela metade é chamado de meia-vida ou período de semi desintegração.
LEIS DA RADIOATIVIDADE:
Quando um átomo radioativo emite uma partícula alfa ocorre:
Decaimento Alfa (α):
- O núcleo perde 2 prótons e 2
- Exemplo:92 U 238 —–> 2α4 + 90 Th234
A massa perde 4 unidades e o número atômico perde 2 unidades
Decaimento Beta ( β) :
6 C 14 —> -1 β0 + 7 N 14
Nesse caso, uma emissão beta não altera o número de massa, mas o número atômico é acrescido de uma unidade: há a conversão de um nêutron em um próton.
Decaimento Gama ( γ) :
Não altera o número de prótons nem de nêutrons, apenas libera energia do núcleo.
Elementos Radioativos
A radioatividade pode ser natural, encontrada em elementos que estão dispostos na natureza ou artificial, pela criação de elementos radioativos em laboratório.
Os elementos radioativos naturais são encontradas na natureza, quando os elementos radioativos são transformados por meio de desintegrações, até chegarem a um elemento químico estável, por exemplo, o urânio, o actínio e o tório.
Os elementos radioativos artificiais são obtidos artificialmente nas reações de transmutação, que produzem um novo elemento químico radioativo, por exemplo: iodo-131 e o fósforo-30.( https://www.todamateria.com.br)
MEIA VIDA :
À medida que a radiação é emitida, o átomo se desintegra, o que resulta na sua transformação, pois é o número atômico que determina o elemento químico.
No decaimento radioativo há a diminuição da atividade radioativa e o tempo que essa desintegração do elemento leva para reduzir a sua massa pela metade é chamado de meia vida ou período de semi desintegração.( https://www.todamateria.com.br)
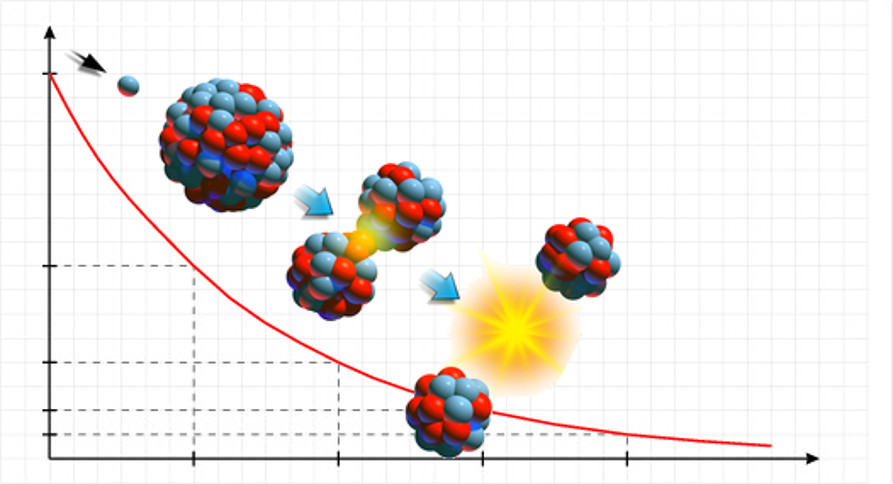
Digamos, por exemplo, que temos uma amostra de 16 g de 1532P. Depois de 14 dias, a massa dessa amostra passou para 8 g (metade de 16). Assim sendo, a meia-vida desse isótopo radioativo é de 14 dias. Observe como isso ocorre a seguir:
16g → 8g → 4g → 2g → 1g → 0,5g → 0,25g → ….
14 dias 14 dias 14 dias 14 dias 14 dias 14 dias 14 dias
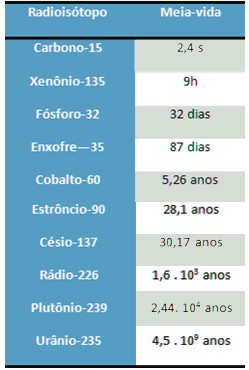
Cada elemento radioativo tem sua meia vida específica;
Exercícios:
1-
Quantas partículas alfa (α) e quantas partículas beta (β) precisam ser emitidas para transformar um urânio-238 (23892U) em rádio (22688Ra):
a) 2 partículas alfa (α) e 3 partículas beta (β).
b) 1 partícula alfa (α) e 2 partículas beta (β).
c) 3 partículas alfa (α) e 2 partículas beta (β).
d) 3 partículas alfa (α) e 3 partículas beta (β).
e) 4 partículas alfa (α) e 3 partículas beta (β).
resolução:
Primeiro vamos escrever a equação nuclear indicando por x e y os números de partículas alfa (α) e beta (β):
23892U → x42 α + y 0-1 β + 22688Ra
Índices superiores: 238 = 4x + 0y + 226 → x = 3
Índices inferiores: 92 = 2x – 1y + 88 → y = 2
Esses valores mostram que é preciso que o urânio-238 emita três partículas alfa (α) e duas partículas beta (β) para transformar-se no rádio. Veja como dá certo substituindo os valores de x e y na equação nuclear:
23892U → 3 42 α + 2 0-1 β + 22688Ra
2-
Detectores de incêndio são dispositivos que disparam um alarme no início de um incêndio. Um tipo de detector contém uma quantidade mínima do elemento radioativo amerício-241. A radiação emitida ioniza o ar dentro e ao redor do detector, tornando-o condutor de eletricidade. Quando a fumaça entra no detector, o fluxo de corrente elétrica é bloqueado, disparando o alarme. Esse elemento se desintegra de acordo com a equação a seguir:
95Am241 → 93Np237 + Z
Nessa equação, é correto afirmar que Z corresponde a:
a) uma partícula alfa.
b) uma partícula beta.
c) radiação gama.
d) raios X.
e) dois prótons.
resolução:
Letra a). O enunciado descreve a emissão natural de radiação (Z) a partir de um átomo de amerício, que apresenta número de massa igual a 241 e número atômico igual a 95, o qual se transforma em um átomo de Netúnio (massa: 237; número atômico: 93).
Como o número de massa entre os dois elementos apresenta uma diferença (241-237) de 4 unidades e seus números atômicos apresentam uma diferença de 2 unidades, podemos afirmar que a radiação (Z) emitida foi a partícula alfa, já que seu número de massa é 4 e seu número atômico é 2.
3-
Com relação à sequência de emissões radioativas naturais propostas a seguir, podemos afirmar que as radiações ou emissões presentes no processo são:
92U238 → 90Th234 → 91Pa234 → …→ 84Po210 → 84Pb206
a) Apenas alfa
b) Apenas beta
c) Radiação alfa e beta
d) Radiação alfa e gama
e) Radiação gama e beta
resolução:
Letra c). Analisando a sequência de átomos, temos que, do átomo U238 para o Th234, Pa234 até o Po210 e do Po210 para o Pb206, está ocorrendo uma redução do número de massa (de 4 em 4 unidades), o que caracteriza emissão alfa. Já do Th234 para o Pa234, temos a manutenção do número de massa e alteração do número atômico, o que caracteriza emissão beta.
4)- O criptônio-89 possui o tempo de meia-vida igual a 3,16 minutos. Dispondo-se de uma amostra contendo 4,0 . 1023 átomos desse isótopo, ao fim de quanto tempo restarão 1,0 . 1023 átomos?
Resolução:
A cada 3,16 minutos, a quantidade de átomos cairá pela metade. Assim, para chegar a um quarto da quantidade inicial, serão necessários dois períodos de meia-vida, ou seja: 3,16 + 3,16 = 6,32 minutos.
4,0 . 1023 átomos → 3,16 minutos → 2,0 . 1023 átomos→ 3,16 minutos → 1,0 . 1023 átomos
5)-O césio-137 possui meia-vida de 30 anos. Se tivermos 12 g desse elemento, após quanto tempo essa massa será reduzida para 0,75 g?
Resolução:
12g → 6g → 3g → 1,5g → 0,75g
30 anos 30 anos 30 anos 30 anos
Serão necessários 120 anos para que essa amostra de césio-137 reduza-se a 0,75 g.
( exercícios retirados do: https://exercicios.brasilescola.uol.com.br/)
FISSÃO E FUSÃO NUCLEAR:
FISSÃO NUCLEAR:
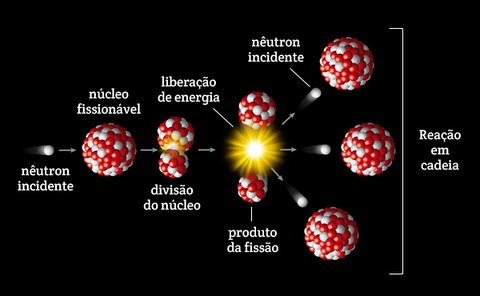
A fissão nuclear é uma reação na qual o núcleo de um átomo pesado se divide em dois (ou mais) núcleos menores, liberando uma grande quantidade de energia. Esse processo pode ocorrer de forma espontânea em isótopos instáveis ou ser induzido pela interação de um núcleo com uma partícula, como um nêutron.
FUSÃO NUCLEAR
A fusão nuclear é uma reação na qual dois núcleos leves se combinam para formar um núcleo mais pesado, liberando uma enorme quantidade de energia. Este processo ocorre naturalmente no interior das estrelas, incluindo o Sol, onde é a fonte de sua imensa produção de energia.
gif de:https://medium.com/me-explica-cienca

