ALÔ PESSOAL!
continuamos com a termoquímica!
Conceito de entalpia:
Conteúdo de energia que cada substancia apresenta.Representa-se por H.
Não se sabe como determinar o conteúdo de energia de uma substancia, mas conseguimos medir a variação da entalpia de um processo através do uso de calorímetros.
Essa quantidade representa a energia liberada ou absorvida durante o processo, à pressão constante.
A variação de entalpia é dada pela expressão:
∆H = H2 – H1
ou
∆H = HP – HR
REAÇÕES EXOTÉRMICAS:
São aquelas que liberam calor. Desta forma a quantidade final de energia será menor que a quantidade inicial.
∆H < 0
GRÁFICO DAS REAÇÕES EXOTÉRMICAS:
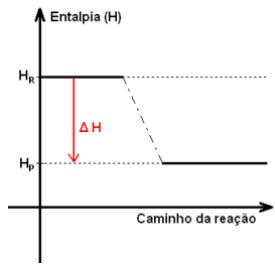
Observe que a quantidade de energia dos reagentes é maior que a energia dos produtos.
REAÇÕES ENDOTÉRMICAS
São aquela que ocorrem com absorção ode calor:assim, a quantidade de energia inicial será menor que a quantidade de energia final:
∆H > 0
GRÁFICO DAS REAÇÕES ENDOTÉRMICAS:
Observe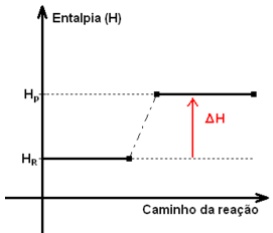
observe que a quantidade de energia dos produtos é maior que a energia dos reagentes, ou seja, absorveu energia no processo.
E um bem interessante:
 |
| papofisico.tumbrl.com |
