ALÔ PESSOAL!
Quem fez ontem o vestibular da UNESP, viu a quantidade de textos e a necessidade de compreensão rápida.Foram abordados temas que sempre coloco no XQUMICA, como terras raras, biocombustiveis e outros:
Questão 53
O uso do álcool combustível é antigo no Brasil. Desde o início do século XX, o país já usava o produto extraído
da cana-de-açúcar para fins energéticos. Com o pré-sal em alta, o açúcar caro lá fora e os canaviais em crise, o biocombustível brasileiro derrapa quando o mundo mais precisa de energia verde.
(Martha San Juan França. O etanol na encruzilhada.
Unesp Ciência
, maio de 2012. Adaptado.)
A partir da leitura do texto e de seus conhecimentos, pode-se afirmar que, no Brasil,
(A) em 1900, iniciaram-se experiências com motores a combustão,
em alguns casos movidos a etanol, provocando o aumento da exportação brasileira desse biocombustível.
(B) com a desativação do Proálcool em 2001, descartou-se a perspectiva do etanol se consolidar no mercado brasileiro
como fonte renovável de energia.
(C) em 1960, a primeira crise do petróleo elevou o preço do barril e a importação consumiu quase metade das divisas
obtidas com a exportação nacional.
(D) dos séculos XVI a XVIII, os engenhos de açúcar se expandiram pela região Nordeste, constituindo a principal
atividade econômica.
(E) a chegada ao mercado dos carros com motor flex provocou aumento significativo da produção do etanol, tornando
o pais autossufuciente.
resposta: D
Questão 69
A areia comum tem como constituinte principal o mineral
quartzo (SiO2) a partir do qual pode ser obtido o silício , que é usado na fabricação de microchips. A obtenção do silício para uso na fabricação de processadores envolve uma serie de etapas. Na primeira, obtem-se o silicio metalurgico, por reação do óxido com coque, em forno de arco elétrico, à temperatura de 1900°C. Uma das equações que descreve o processo é apresentada a seguir:
SiO2(s) + 2C(s) → Si(l) + 2CO(g)
Dados:
delta Hº SiO = –910,9 kJ · mol
delta Hº CO = –110,5 kJ · mol
De acordo com as informações do texto, é correto afirmar que
o processo descrito para a obtenção do silício metalúrgico corresponde
a uma reação
(A) espontânea, na qual ocorre a combustão do carbono.
(B) exotérmica, na qual ocorre a redução do óxido de silício.
(C) exotérmica, na qual ocorre a substituição do Si por C.
(D) endotérmica e de dupla troca.
(E) endotérmica e de oxirredução, na qual o Si4+ é reduzido a Si
Resposta: E – delta H final é maior que o delta H inicial, então a reação absorve calor, endotermica.O silicio ganha 4 eletrons, então é redução.
I
Instrução: Leia o texto para responder às questões de números
70 e 71
O silício metalúrgico, purificado até atingir 99,99% de pureza, é conhecido como silício eletrônico. Quando cortado em fatias finas, recobertas com cobre por um processo eletrolítico
e montadas de maneira interconectada, o silício eletrônico e transforma-se em microchips
A figura reproduz uma das últimas etapas da preparação
As fatias de silício são
colocadas numa solução
de sulfato de cobre. Nesse
processo, íons de cobre
deslocam-se para a superfície
da fatia (cátodo), aumentando
(http://umumble.com. Adaptado.)
Questão 70
O processo de recobrimento das fatias de silício é conhecido
Resposta: B pela figura observa-se os ions de cobre “sobem” em direção ás fatias de silicio.
Questão 71
A semirreação na superfície da fatia de silício, cátodo, é representada
por:
(A) Cu2+ + 2e– → Cu(s).
(B) Si(s) + 4e– → Si4+(s).
(C) 2Cu + + H2O → 2Cu(s) + H2O + 2e–.
(D) Cu2+ + 2H2O → O2(g) + 4H+ + Cu(s).
(E) 2(SO4)-2–> (S2O8) -2 + 2 e-
Resposta: A – No cátodo ocorre redução, ou seja os eletrons são “aderidos” aos ions cobre e tornando-se obre metálico.Lembre que o sulfato não participa da reação.
Instrução: Leia o texto para responder às questões de números 72 a 74
Alguns cheiros nos provocam fascínio e atração. Outros
trazem recordações agradáveis, até mesmo de momentos da
infância. Aromas podem causar sensação de bem-estar ou dar
a impressão de que alguém está mais atraente. Os perfumes
têm sua composição aromática distribuída em um modelo conhecido
como pirâmide olfativa, dividida horizontalmente em
três partes e caracterizada pelo termo nota. As notas de saída,
constituídas por substâncias bem voláteis, dão a primeira impressão
do perfume. As de coração demoram um pouco mais
para serem sentidas. São as notas de fundo que permanecem
mais tempo na pele
(Cláudia M. Rezende.
Ciência Hoje, julho de 2011. Adaptado.)
Questão 72
À temperatura e pressão ambientes, os constituintes químicos das notas de saída
(A) são líquidos oleosos que aderem à pele por meio de ligações de hidrogênio.
(B) são gases cujas moléculas possuem elevada polaridade.
(C) apresentam densidade mais elevada que os constituintes químicos das notas de coração e de fundo.
(D) evaporam mais rapidamente que os constituintes químicos das notas de coração e de fundo.
(E) são pouco solúveis no ar atmosférico.
Resposta: D as notas de saída, segundo a piramide ( não do original) são as notas de cabeça, ou seja as primeiras que evaporam.
Questão 73
Um químico, ao desenvolver um perfume, decidiu incluir entre os componentes um aroma de frutas com concentração máxima de 10-4 mol
Ele dispõe de um frasco da substância aromatizante, em solução hidroalcoólica, com concentração de 0,01 mol/L.
Para a preparação de uma amostra de 0,50 L do novo perfume,contendo o aroma de frutas na concentração desejada, o volume da solução hidroalcoólica que o químico deverá utilizar
será igual a
(A) 0,50 mL.
(B) 2,0 mL.
(C) 5,0 mL.
(D) 0,20 mL.
(E) 1,0 mL.
Resposta C – 0,5 x 10-4 = X x 0,01
—————X = ,5 x 10-4 / 10-2 = 0,5 x 10 -2 litros = 5 mililitros
Questão 74
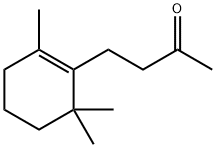
A β-ionona éuma substâcia quíica de vasta aplicação na
perfumaria, em produtos cuja fórmula requer aroma floral.
β-ionona
A substância química β-ionona
(A) apresenta, em soluções aquosas, atividade óptica.
(B) possui grupos funcionais com propriedades oxidantes.
(C) reage com água, formando diois vicinais.
(D) contém três grupos metila, ligados a átomos de carbono
idênticos.
E) contém duplas ligações conjugadas.
Resposta: E –
Questão 75
Em um laboratório de química, dois estudantes realizam um
experimento com o objetivo de determinar a velocidade da
reação apresentada a seguir.
MgCO3(s) + 2HCl(aq) → MgCl2(aq) + H2O(l) + CO2(g)
Sabendo que a reação ocorre em um sistema aberto, o parâmetro do meio reacional que deverá ser considerado para a determinação da velocidade dessa reação é
(A) o teor de umidade no interior do sistema.
(B) a diminuição da massa total do sistema.
(C) a diminuição da concentração de íons Mg2+
(D) a variação da concentração de íons Cl-
(E) a elevação da pressão do sistema.
Resposta B – umavez que o sistema é aberto, o gás carbonico vai evaporar diminuindo a massa do
Desculpem, mas algumas figuras não foram transferidas, então utilizei similares do Googles Images, o que não compromete a resolução das questões.Esse é o caderno 4, então veja no seu as questões correspondentes.
E atacaremos a FUVEST na próxima edição!!!!!!!!!!!!