Mais uma aula só de exercícios resolvidos para você que vai enfrentar provas e vestibulares.
Com certeza, quem não tem base, não resolve o mais complicado.
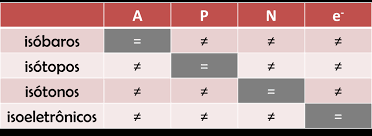
Primeiro vamos às definições, depois aos problemas:
ISÓTOPOS= 2 OU MAIS ÁTOMOS QUE TEM O MESMO NÚMERO ATÔMICO OU NÚMERO DE PRÓTONS.
ISÓBAROS = 2 OU MAIS ÁTOMOS QUE TEM MESMO NÚMERO MASSA ( SOMA DE PRÓTONS E NÊUTRONS) .
ISÓTONOS = 2 OU MAIS ÁTOMOS QUE TEM O MESMO NÚMERO DE NÊUTRONS ( QUE VOCÊ ACHA ATRAVÉS DE MASSA – NÚMERO ATÔMICO )
PROBLEMAS:
1) O átomo “X” é isótono do átomo 55Mn25 e isoeletrônico do íon60 Ni 282+. Com base nisso, indique o número de massa do átomo “X”:
* Isoeletrônicos significa que possuem o mesmo número de elétrons !
X é isótono de Mn então tem o mesmo número de nêutrons : 55-25= 30
X é isoeletrônico do íon Ni +2, o que significa que tem 26 elétrons ( lembra que perdeu 2 elétrons)
X é um átomo, então número 26 também é seu número atômico.
Logo o número de massa será a soma de prótons e nêutrons= 30 + 26 = 56 !!
2) X é isótopo de 41Ca20 e isótono de 41K 19 . Portanto, o seu número de massa é igual a:
X é isótopo de Ca então o número atômico de X = 20
X é isótono de K , então ele tem 41- 19 nêutrons = 22
X tem número de massa igual a prótons + nêutrons 20 + 22 = 42
3) Determine o número atômico e o número de massa dos átomos A e B, que são isóbaros e apresentam a seguinte representação:
10+x A 5x 11+x B 4x+8
aqui você tem uma equação matemática que vai ter que resolver primeiro:
COMO OS ÁTOMOS SÃO ISÓBAROS 5X = 4X + 8 E VOCÊ VAI DETERMINAR O VALOR DE X.
Depois de fazer isso, vai substituir o x nas equações acima e descobrir os números atômicos e os números de massa dos átomos A e B .
Na equação dada 5x= 4x+ 8 ==> o valor de x = 8
Substituindo no átomo A : 5.8= 40 ( número de massa de A )
10 + 8 = 18 – número atômico de A
Substituindo no átomo B: 4.8 +8 = 40 ( número de massa de B )
11 + 8 = 19 – número atômico de B
Representando:
40 A 18 40 B 19
4) Com relação aos átomos abaixo:
21X50 22Y50 21R49
Podemos afirmar que:
- a) Y e R são isótopos.
- b) X e R são isóbaros.
- c) X e R são isótonos.
- d) X e R possuem o mesmo número de elétrons.
- e) X e Y deveriam estar representados pelo mesmo símbolo químico.
Letra d). Os átomos X e R apresentam o mesmo número de elétrons (21).
5) (IFSP) Considere a tabela a seguir, que fornece características de cinco átomos (I, II, III, IV e V).

São isótopos entre si os átomos:
- a) I e I I.
- b) I I. e III.
- c) I, I I. e III.
- d) III e IV.
- e) IV e V.
Letra a). Para serem isótopos, os átomos devem apresentar o mesmo número atômico ou o mesmo número de prótons, o que ocorre com os átomos I e II.
6) -(UCS) No organismo humano, alguns dos elementos químicos existem na forma de íons. Esses íons desempenham um papel fundamental em vários processos vitais, participando de reações químicas. Os íons 11Na+ e 12Mg2+, por exemplo, estão, respectivamente, envolvidos no equilíbrio eletrolítico e no funcionamento dos nervos. Em relação aos íons 23Na+ e 24Mg2+, é correto afirmar que são
- a) isótopos e isoeletrônicos.
- b) isoeletrônicos e isótonos.
- c) isótonos e isóbaros.
- d) isóbaros e isótopos.
- e) isoeletrônicos e isóbaros.
Letra b). O exercício fornece as seguintes informações sobre os cátions Na+ e Mg+2:
Para o Na+:
– Número atômico = 11
– Número de prótons = 11
– Número de elétrons = 10 (ele perde um elétron – carga +)
– Número de massa = 23
– Número de nêutrons = 12 (resultado da subtração da massa (23) pelo número atômico (11))
Para o Mg+2:
– Número atômico = 12
– Número de prótons = 12
– Número de elétrons = 10 (ele perde dois elétrons – carga +2)
– Número de massa = 24
– Número de nêutrons = 12 (resultado da subtração da massa (24) pelo número atômico (12))
Como os cátions apresentam o mesmo número de elétrons e o mesmo número de nêutrons, são classificados, respectivamente, em isoeletrônicos e isótonos.
RESUMO:
Pesquisa: https://exercicios.mundoeducacao.uol.com.br/exercicios-quimica/

