Nas aulas anteriores você viu que os elementos químicos são muitos. Dessa forma foi necessário criar uma maneira de colocá-los em ordem, para que pudessem ser visualizados segundo suas propriedades em comum.
Desta maneira foi criada a TABELA PERIÓDICA – uma organização que levou algumas etapas, mas o resultado é o que importa agora.
MAS ANTES DE QUALQUER COISA, DOIS CONCEITOS IMPORTANTES: NÍVEIS E SUBNÍVEIS DE ENERGIA:
OS NÍVEIS DE ENERGIA SÃO AS CAMADAS K,L,M,N,O,P,Q – ESTÃO AO REDOR DO NÚCLEO. CADA CAMADA DEPENDE DO NÚMERO DE ELÉTRONS QUE ESTÁ AO SEU REDOR.
EXEMPLO: ELEMENTO LÍTIO TEM NÚMERO ATÔMICO =3 ENTÃO TEM 3 PRÓTONS E 3 ELÉTRONS. ESSES ELÉTRONS ESTÃO EM 2 CAMADAS- CAMADA K E CAMADA L .
MAS COMO SABER ISSO???
CADA NÍVEL DE ENERGIA POSSUI SUBNÍVEIS, COMO SE FOSSE UMA RUA COM SUAS CASAS. CADA SUBNÍVEL COMPORTA UM DETERMINADO NÚMERO DE ELÉTRONS ( SENÃO VIRA UMA BAGUNÇA!)
OS SUBNÍVEIS SÃO : S ; P; D; F – VAMOS FALAR DELES NA PRÓXIMA AULA!
TABELA ATUAL :

Nessa tabela OS ELEMENTOS ESTÃO ORGANIZADOS DE ACORDO COM O SEU NÚMERO ATÔMICO – você vê o número atômico, que é crescente, partindo do H = 1 até Og = 118. ( 32 naturais e 26 artificiais).
O número de massa está ao lado. Em algumas tabelas está abaixo do elemento. Mas a representação é sempre o numero de massa ( A ) acima do elemento e o número atômico ( Z ) abaixo do elemento: ESSA REPRESENTAÇÃO É USADA NOS EXERCÍCIOS- NÃO SE ESQUEÇA!
São 7 períodos, sete linhas horizontais. E 18 famílias, ou linhas verticais. As famílias possuem propriedades que são iguais para todos os componentes.
Por isso recebem nomes diferenciados:
As Famílias ou Grupos são as colunas verticais, no qual os elementos possuem o mesmo número de elétrons na camada mais externa, ou seja, na camada de valência. Muitos elementos destes grupos estão relacionados de acordo com suas propriedades químicas.
São dezoito Grupos (A e B), sendo que as famílias mais conhecidas são do Grupo A:
- Família 1A: Metais Alcalinos (lítio, sódio, potássio, rubídio, césio e frâncio).Possui 1 elétron na camada de valência.
- Família 2A: Metais Alcalino-Terrosos (berílio, magnésio, cálcio, estrôncio, bário e rádio).
- Família 3A: Família do Boro (boro, alumínio, gálio, índio, tálio e nihonium).
- Família 4A: Família do Carbono (carbono, silício, germânio, estanho, chumbo e fleróvio).
- Família 5A: Família do Nitrogênio (nitrogênio, fósforo, arsênio, antimônio, bismuto e moscóvio).
- Família 6A: Calcogênios (oxigênio, enxofre, selênio, telúrio, polônio, livermório).
- Família 7A: Halogênios (flúor, cloro, bromo, iodo, astato e tennessine).
- Família 8A: Gases Nobres (hélio, neônio, argônio, criptônio, xenônio, radônio e oganesson).
As famílias A sempre terminam em s ou sp.( os subníveis)

As famílias B terminam em d ou f :
ELEMENTOS DE TRANSIÇÃO
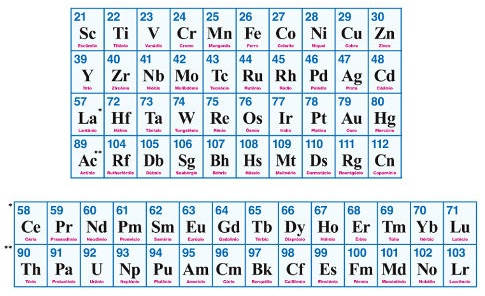
Os elementos de transição, também chamados de metais de transição, representam as 8 famílias do Grupo B:
- Família 1B: cobre, prata, ouro e roentgênio.
- Família 2B: zinco, cádmio, mercúrio e copernício.
- Família 3B: escândio, ítrio e sério de lantanídeos (15 elementos) e actinídeos (15 elementos).
- Família 4B: titânio, zircônio, háfnio e rutherfórdio.
- Família 5B: vanádio, nióbio, tântalo e dúbnio.
- Família 6B: cromo, molibdênio, tungstênio e seabórgio.
- Família 7B: manganês, tecnécio, rênio e bóhrio.
- Família 8B: ferro, rutênio, ósmio, hássio, cobalto, ródio, irídio, meitnério, níquel, paládio, platina, darmstádio.
Os elementos químicos da Tabela Periódica são classificados em cinco grandes grupos: metais, ametais (ou não metais), semimetais, gases nobres e hidrogênio.
ELEMENTOS REPRESENTATIVOS: são os elementos das famílias A . São divididos em:
FAMÍLIA 1A – metais alcalinos
Os metais alcalinos são sólidos, porém, macios; além disso, podem ser cortados com uma faca, mas são altamente reativos. Como é o caso do sódio, que explode violentamente ao ser colocado em contato com a água
FAMÍLIA 2 A- metais alcalinos terrosos
Metais alcalinoterrosos, sendo que o termo “terroso” refere-se a “existir na terra”.
Os mais importantes entre esses metais são o magnésio e o cálcio, sendo muito abundantes na natureza. Por exemplo, o cálcio está presente na forma de seus vários minerais, como o carbonato de cálcio do mármore e do calcário, e na gipsita (sulfato de cálcio di-hidratado) usada como gesso.
FAMÍLIA 13A– família do alumínio
O alumínio é o mais importante deles, pois é bastante utilizado em estruturas e em objetos em vários setores da sociedade, tais como na construção civil, nos transportes (como em carrocerias de automóveis, embarcações, fuselagens de aviões e em aros de bicicletas), em eletroeletrônica, na indústria petroquímica e metalúrgica, em tampas de iogurte, frigideiras, papel alumínio e assim por diante.
FAMÍLIA 14 A – família do carbono
O carbono é o mais importante porque ele é tetravalente, sendo capaz de formar quatro ligações com vários elementos, inclusive com ele próprio, formando as chamadas cadeias carbônicas. Em virtude da enorme quantidade de compostos do carbono, que são chamados de compostos orgânicos, criou-se um ramo na Química dedicado somente ao estudo dessas substâncias, a Química Orgânica
FAMÍLIA 15 A– nitrogênio
O nitrogênio forma o gás (N2) mais abundante na atmosfera, possui grande importância para a manutenção da vida e é usado como gás refrigerante.
FAMÍLIA 16 A – calcogênios
Palavra que significa “formadores de cobre”, porque os minérios de cobre contêm oxigênio ou enxofre que são elementos dessa família.
O elemento mais importante é o oxigênio utilizado nas funções respiratórias e fotossíntese.
FAMÍLIA 17 A – halogênios
Tem esse nome porque são formadores de sais. O elemento mais importante é o cloro
usado em desinfecção .
FAMÍLIA 18 A– gases nobres
Eles são os únicos elementos encontrados, em sua forma isolada, estáveis na natureza.
Metais de transição: são 32 elementos pertencentes às colunas 3 a 12 ou 3B, 4B, 5B, 6B, 7B, 8B, 1B e 2B*.
- Metais de transição interna: são 26 elementos da série dos Lantanídeos e dos Actinídeos.
- 10 metais não se encaixam em nenhum desses.
- Ametais ou Não metais: são os 11 elementos indicados na Tabela acima pela cor rosa: Carbono (C), Nitrogênio (N), Fósforo (P), Oxigênio (O), Enxofre (S), Selênio (Se), Flúor (F), Cloro (Cl), Bromo (Br), Iodo (I) e Astato (At).
- Semimetais: esta nomenclatura está em desuso, pois a IUPAC (União Internacional de Química Pura e Aplicada) não reconhece mais essa classificação desde 1986. Entretanto, em muitas Tabelas sete elementos ainda são classificados dessa forma, pois possuem características intermediárias às dos metais e às dos ametais.
- Gases Nobres: representam os elementos da família 18 (0 ou VIII A), que são, respectivamente: hélio, neônio, argônio, criptônio, xenônio e radônio. Esses elementos são gasosos na temperatura ambiente e, normalmente, são encontrados na natureza em sua forma isolada, pois assim são mais estáveis. Além disso, eles não formam compostos com outros elementos espontaneamente.
- Hidrogênio : esse elemento não se enquadra em nenhum grupo da Tabela Periódica. Em algumas Tabelas ele aparece na família dos alcalinos, por possuir um elétron em sua camada de valência. Aliás, essa é sua única camada eletrônica. Porém, suas características não são semelhantes às dos elementos dessa família.
fontes: WWW.RIOCITIES.COM
WWW.TODAMATERIA.COM.BR
HTTP://MUNDOEDUCACAO.BOL.UOL.COM.BR

