A isomeria é um fenômeno que ocorre quando duas ou mais substâncias diferentes possuem a mesma fórmula molecular, mas diferentes propriedades e fórmulas estruturais.
Por exemplo, o etanol e o metoximetano são compostos totalmente diferentes. O etanol é do grupo dos álcoois, é líquido em temperatura ambiente, é incolor, ferve a 78,5ºC e apresenta uma certa reatividade. Já o metoximetano é do grupo dos éteres, é um gás em temperatura ambiente, ele se liquefaz somente a -23,6ºC e quase não apresenta reatividade química. Apesar de tão diferentes, esses dois compostos possuem a mesma fórmula molecular – C2H6O.
Conforme se pode ver abaixo, o que os distingue é o fato de que a disposição dos átomos dos elementos em cada composto é diferente. Veja que o oxigênio aparece entre os carbonos no caso do metoximetano, enquanto que no etanol ele aparece fora da cadeia carbônica:”
“H3C — O — CH3 H3C —CH2 — OH
Metoximetano Etanol
Dizemos, então, que o metoximetano é isômero do etanol.
A isomeria se divide em duas grandes áreas:
- Isomeria plana ou constitucional;
- Isomeria espacial ou estereoisomeria.
a) Isomeria plana ou constitucional
É a isomeria em que os compostos apresentam a mesma fórmula molecular, mas fórmulas estruturais planas diferentes. Esse fenômeno origina substâncias completamente diferentes em relação às propriedades físicas e químicas. Os tipos de isomeria plana são:
- Isomeria plana de função: os isômeros pertencem a diferentes funções;
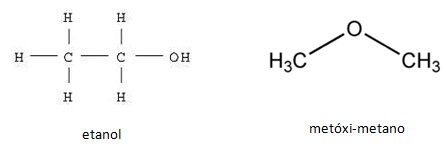
- Isomeria plana de cadeia: os isômeros pertencem à mesma função, mas apresentam cadeias planas com características diferentes;
|
|
| www.infoescola.com |
- Isomeria plana de posição: os isômeros pertencem à mesma função, a mesma caraterística de cadeia, mas diferem quanto à posição de algum grupo (ramificação, insaturação ou grupo funcional);

- Isomeria plana por metameria: os isômeros pertencem à mesma função, possuem a mesma caraterística de cadeia, mas diferenciam-se quanto à posição de um heteroátomo;
- Isomeria plana por tautomeria: tipo especial de isomeria que ocorre entre um enol e um aldeído ou entre um enol e uma cetona.
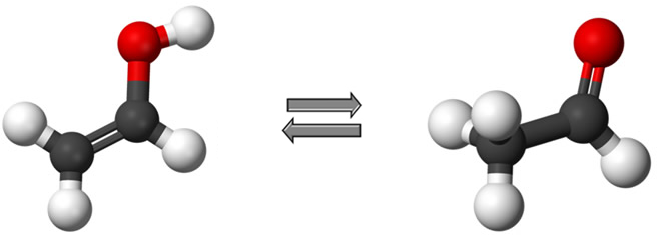
Um dos tipos de isomeria constitucional é a tautomeria, que é a única que é dinâmica, ou seja, os isômeros coexistem em um mesmo sistema em equilíbrio dinâmico.
Isso ocorre sempre em sistemas líquidos, e os principais exemplos de tautomeria ocorrem com enóis, aldeídos e cetonas. Essa isomeria ocorre com esses compostos porque eles possuem um elemento muito eletronegativo (o oxigênio) ligado a um carbono insaturado, isto é, que faz uma dupla ligação. Desse modo, o oxigênio atrai fortemente os elétrons da dupla ligação, que é fraca e fácil de se deslocar, e um isômero transforma-se no outro.
Veja um exemplo abaixo de um equilíbrio aldoenólico, isto é, entre um aldeído e um enol, que possuem a mesma fórmula molecular C2H4O:
Etanal Etenol
O OH
║ │
H3C — C — H ↔ H2C ═ C — H
aldeído enol https://www.preparaenem.com
Esse equilíbrio existe quando uma solução de aldeído acético (etanal) é preparada, sendo que uma pequena parte se transforma em etenol, que, por sua vez, regenera-se novamente em aldeído, estabelecendo o equilíbrio dinâmico.
Tautomeria ceto-enólica:
Prop-1-en-2-ol Propanona
OH O
│ ║
H2C ═ C — CH3 ↔ H3C — C — CH3
ENOL CETONA

1-Relacione as duas colunas abaixo, indicando o tipo de isomeria plana que ocorre entre os pares de compostos orgânicos mencionados na segunda coluna:
| 1ª Coluna: | 2ª Coluna: |
| I. Isomeria de função | a) dimetilamina e etilamina. |
| II. Isomeria de posição | b) etoxietano e metoxipropano. |
| III. Isomeria de cadeia | c) 1-propen-2-ol e propanona. |
| IV. Metameria | d) metanoato de metila e ácido etanoico. |
| V. Tautomeria | e) but-1-eno e but-2-eno. |
I. d
II. e
III. a
IV. b
V. c
Veja:
a) dimetilamina e etilamina: isomeria de cadeia → a primeira é heterogênea e a segunda é homogênea:
H3C — NH — CH3 H3C — CH2 — NH2
b) etoxietano e metoxipropano: metameria → a posição do heteroátomo está diferente:
H3C — O — CH2 — CH2 — CH3 H3C — CH2 — O — CH2 — CH3
c) 1-propen-2-ol e propanona: tautomeria cetoenólica→ ocorre entre um enol e uma cetona:
OH O
| ||
H2C = C — CH3 ↔ CH3 — C — CH3
d) metanoato de metila e ácido etanoico: isomeria de função → o primeiro é um éster e o segundo é um ácido carboxílico:
O O
// //
H — C CH3 — C
\\ \\
O — CH3 OH
e) but-1-eno e but-2-eno: isomeria de posição → a posição da insaturação (ligação dupla) é diferente:
H2C = CH — CH2 — CH3 H3C — CH = CH — CH3
2-Os ácidos graxos ômega-3 (ácido linolenílico ou ácido cis-9-cis-12-cis-15-octadecadienoico) e ômega-6 (ácido linoleico ou ácido cis-9-cis-12-octadecadienoico), presentes em peixes gordurosos, como o salmão, atum e sardinha, e óleos vegetais, como o de nozes, de avelã e de amêndoas, são essenciais para o organismo humano. Esses dois compostos são isômeros entre si. Suas fórmulas estão representadas abaixo:

Estruturas dos isômeros ômega-3 e ômega-6
O ômega-3 e o ômega-6 apresentam que tipo de isomeria plana?
a) De função.
b) De cadeia.
c) De posição.
d) Metameria.
e) sem isomeria.
resposta:
Alternativa “e”.
Não são isômeros, porque as duas estruturas não apresentam a mesma fórmula molecular, fato este que pode ser comprovado apenas comparando o número de ligações duplas (pois, quanto mais duplas menos hidrogênios).
3-
(EsPCEx-SP) O brometo de benzila, princípio ativo do gás lacrimogêneo, tem fórmula molecular C7H7Br. A fórmula desse composto admite a seguinte quantidade de isômeros:
a) 2
b) 4
c) 5
d) 6
e) 8
resposta:
Alternativa “b”.
O brometo de benzila é isômero do o-bromometilbenzeno, m-bromometilbenzeno e p-bromometilbenzeno:

exercícios de: https://exercicios.mundoeducacao.uol.com.br