ISOMERIA GEOMÉTRICA
Isomeria Geométrica é o tipo de isomeria espacial, também conhecida como estereoisomeria, que se caracteriza por apresentar uma dupla de isômeros com dimensões tridimensionais diferentes. Isso acontece em decorrência da presença de ligantes diferentes.
Também conhecida como isomeria cis-trans, ela somente é possível em cadeias abertas que apresentem dupla ligação de carbono, ou seja, em cadeias abertas insaturadas.
A isomeria geométrica, entretanto, não acontece apenas em cadeias abertas, também pode acontecer em compostos cíclicos.
Os isômeros não são diferenciados pela sua fórmula estrutural plana, mas sim pela sua disposição no espaço. Assim, precisamos de modelos moleculares espaciais para conseguir identificar a isomeria.
Cis e Trans
Quando os ligantes dos carbonos da substância química encontram-se estruturalmente posicionados do mesmo lado, a isomeria é chamada de cis.
Quando os ligantes dos carbonos da substância química encontram-se estruturalmente posicionados do lado oposto, a isomeria é chamada de trans.
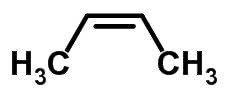
Forma molecular de cis-but-2-eno C4H8
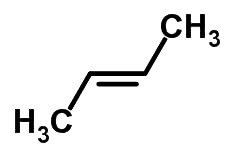
Forma molecular de trans-but-2-eno C4H8
Entendendo melhor:
Para compreendermos este tipo de isomeria precisamos saber como funciona a divisão da molécula no plano. Devemos considerar uma linha imaginária no sentido vertical na molécula abaixo:
Condições para haver isomeria geométrica:
- Presença de dupla ligação onde é estabelecido o plano para rotação da molécula; ou ainda o composto ser cíclico e neste caso o próprio ciclo atua como a dupla ligação.
- Cada carbono da dupla apresentar ligantes diferentes.
Outro exemplo:
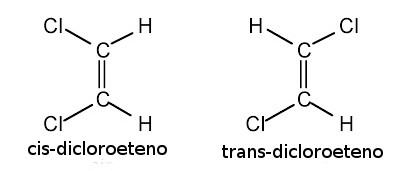
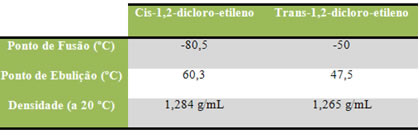
No entanto, no caso do 1,2-dicloroetileno, teremos sim dois isômeros cis-trans:
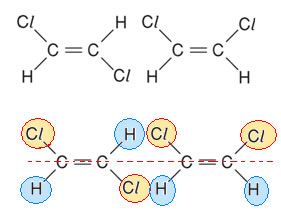
Isomeria Geométrica em Compostos Cíclicos
Em compostos cíclicos, os ligantes têm de ser diferentes no mínimo em dois carbonos.
Nesse caso, podem ocorrer isômeros cis e trans ao mesmo tempo.
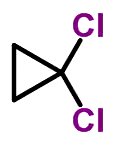
Forma molecular de cis-diclorociclopropano C3H4Cl2
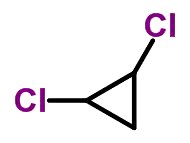
Forma molecular de trans-diclorociclopropano C3H4Cl2
Nomenclatura
É por isso que a nomenclatura dos isômeros geométricos contém os prefixo cis e trans no nome, o que serve de identificação das substâncias.
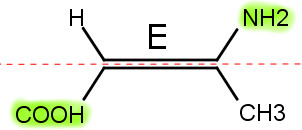
Cis e trans podem ser substituídos pelas iniciais Z e E, respectivamente. É essa a nomenclatura aconselhada pela IUPAC (União Internacional de Química Pura e Aplicada).
Isso porque Z, do alemão zusammen, significa “juntos”. E, do alemão entegegen, significa “opostos”.
FIQUE LIGADO:
São exemplos de aplicações da isomeria geométrica no cotidiano as gorduras presentes nos alimentos. Muito ouvimos falar atualmente nas GORDURAS TRANS, pois estas moléculas possuem este tipo de isomeria. Sabemos que este tipo de gordura é extremamente prejudicial ao nosso organismo podendo ocasionar aumento no COLESTEROL, obstruções coronarianas e levar a sérios problemas cardíacos. Ela não é muito comum na natureza, porém é produzida para uso em alimentos industrializados a partir da gordura vegetal. Grandes quantidades desta gordura são encontradas em alimentos como bolos, bolachas recheadas e derivados. Já em menor quantidade encontramos na carne e no leite.
Os isômeros cis e trans tem propriedades físicas como ponto de fusão e ebulição diferentes devido a diferença nas estruturas. As moléculas trans geralmente são mais estáveis que seus isômeros cis devido ao afastamento entre os grupamentos iguais que tendem a se repelir mais fortemente.
pesquisa:https://www.infoescola.com, https://mundoeducacao.uol.com.br, https://www.infoescola.com
EXERCÍCIOS:
1- Qual dos compostos abaixo apresenta isomeria geométrica cis-trans?
a) pent-2-eno
b) pent-1-eno
c) ciclobutano
d) 1,2-dimetilciclobutano
e) pentano
RESPOSTA:
Letra d)
A resposta é a letra d porque:
a- Pente-2-eno não apresenta isomeria geométrica cis-trans. Sua isomeria é E-Z, pois os ligantes nos carbonos 2 – hidrogênio (H) e metil (CH3) – e os ligantes no carbono 3 – hidrogênio e etil (-CH2-CH3) – são diferentes. Quando comparamos os ligantes dos carbonos do etil, eles também são diferentes.
b- Não apresenta, pois o carbono de número dois está ligado a dois átomos iguais:
c- Não apresenta, pois não existem dois carbonos que apresentam dois ligantes diferentes:
d- Apresenta, pois os ligantes dos carbonos 1 e 3 são diferentes, porém, quando comparamos os ligantes de um carbono com os do outro, eles são iguais entre si:
e- Não apresenta, pois a cadeia é aberta saturada:
2-
Qual das fórmulas não apresenta isomeria cis-trans?
a)
b)
c)
d)
e)
RESPOSTA:
Letra b)
Para que a substância apresente isomeria cis-trans, é necessário que a estrutura apresente uma das características abaixo:
• Ter cadeia aberta, uma ligação dupla e cada carbono da ligação dupla apresentar dois ligantes diferentes;
• Ter cadeia fechada, saturada (só com ligações simples), apresentando dois carbonos que possuam dois ligantes diferentes.
Observando a estrutura do 1,1,2-tricloro-eteno, temos a presença de dois átomos de cloro no mesmo átomo de carbono. Logo, não apresenta isomeria geométrica.

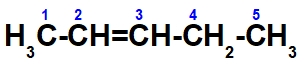
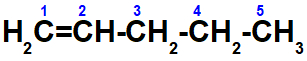
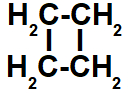
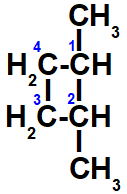
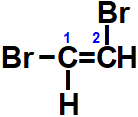
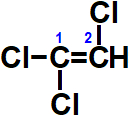
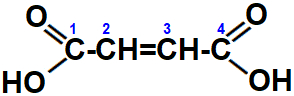
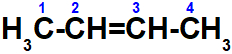
.jpg)