ELETRÓLISE
Eletrólise é uma reação não espontânea provocada pelo fornecimento de energia elétrica, proveniente de um gerador (pilhas). É O INVERSO DAS PILHAS.
Aplicações:
A eletrólise possui muitas aplicações na indústria química, na produção de metais, como sódio, magnésio, potássio, alumínio e etc. Também na produção de não-metais como cloro e o flúor e ainda substâncias como o hidróxido de sódio (soda cáustica) e peróxido de hidrogênio (água oxigenada) .
Galvanização é a deposição de finas películas de metais sobre peças metálicas ou plásticas. Os mais comuns são a deposição de cromo (cromagem), níquel (niquelagem), prata (prateação), ouro (dourar), usados em grades, calotas de carros, emblemas, peças de geladeira, joias, aparelhos de som.
É utilizada também na purificação ou refino eletrolítico de muitos metais, como cobre e chumbo.
Anodização, é uma oxidação forçada na superfície de um metal para que seja mais resistente à corrosão. É feita a anodização em alumínio.
Na eletrólise, usa-se eletrodos inertes (que não regem), como o carbono grafite (grafita) ou platina.
Para que a eletrólise ocorra deve haver:
– corrente elétrica contínua e voltagem suficiente para provocar a eletrólise;
– íons livres ( por fusão ou dissolução)
Existe a eletrólise ígnea e a eletrólise aquosa.
ELETRÓLISE IGNEA :
É uma eletrólise onde não há presença de água. Metais iônicos são fundidos (derretidos). Ao se fundirem, eles se ionizam formando íons. A partir desses íons, é formada a corrente elétrica.
Reação de fusão (transformação do estado físico sólido para líquido) do NaCl a 808°C:
![]()
Os eletrodos devem ser inertes. Pode ser carbono grafite ou platina.
Estes eletrodos são polarizados, um com carga negativa e o outro com carga positiva e são colocados em uma cuba com o metal NaCl já fundido (CLORETO DE SÓDIO LÍQUIDO)

Observe que no desenho há dois eletrodos carregados eletricamente, o polo positivo e o polo negativo, mergulhados em um metal fundido. A reação acima mostra a formação de íons Na+ e íons Cl-. Quando estes íons entrarem em contato com os eletrodos, o íons positivo (Na+) irá para o eletrodo negativo. O íon negativo (Cl-) irá para o eletrodo positivo.
No eletrodo negativo haverá formação de sódio metálico (Na°). No eletrodo positivo formará gás cloro (Cl2). Percebe-se a formação de bolhas.
O eletrodo positivo é chamado de ânodo e nele ocorre a reação de oxidação.
O eletrodo negativo é chamado de cátodo e nele ocorre a reação de redução.
Reações:

A reação do cátodo deve ser multiplicada por 2 para poder cancelar com a reação do ânodo, já que forma gás cloro (Cl2).

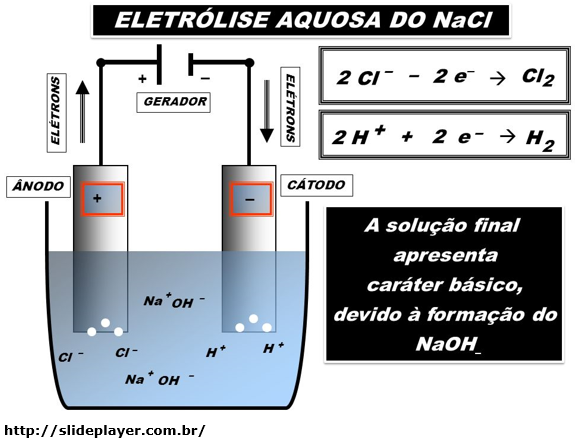
ELETRÓLISE AQUOSA
É uma eletrólise onde há a dissociação de um composto iônico em solução aquosa. O eletrodo deve ser inerte.
É necessário considerar a reação de auto-ionização da água, onde produz íon H+ e íon OH-.
O composto iônico é dissolvido em água, ocorrendo a formação de íons livres, que produzirão a corrente elétrica. Deve ser montada as quatro reações para obter a reação global desta eletrólise.

Nesta cuba eletrolítica deve haver água e o composto iônico dissolvidos. Da auto-ionização da água, formará íons H+ e íons OH-.
Se o composto for um sal, o NaCl, em contato com a água, formará o íon Na+ e o íon Cl-.
Os íons positivos serão atraídos pelo eletrodo negativo e os íons negativos serão atraídos pelo eletrodo positivo. Cada par de íons (positivo e negativo) competirão entre si para ver qual se formará ao redor do seu respectivo eletrodo.
Existe uma tabela de facilidade de descarga elétrica, entre cátions e ânions:
Cátions:
Alcalinos
Alcalinos Terrosos
Al3+ < H+ < demais cátions
Ordem Crescente de Facilidade de Descarga dos Cátions
Ânions:
Ânions Oxigenados < OH- < ânions não-oxigenados < halogênios
Ordem Crescente de Facilidade de Descarga dos Ânions
Observando a tabela, deve-se comparar então os seguintes íons:
– Cl- e OH-
– H+ e Na+
De acordo com a tabela, o íon Cl- (halogênio) tem mais facilidade do que o íon OH-.
De acordo com a tabela, o íon H+ tem mais facilidade do que o íon Na+.
Então, formam-se nos eletrodos, o gás hidrogênio (H2) e o gás cloro (Cl2).
No polo (-) = H+
No polo (+) = Cl-
Reações:

Observe que forma o H2 e Cl2.
Também forma 2Na+ e 2OH-. Juntando estes dois íons, forma-se 2NaOH.

1-(Unifor-CE) As proposições a seguir estão relacionadas com eletrólise:
I. As reações de eletrólise ocorrem com consumo de energia elétrica.
II. Soluções aquosas de glicose não podem ser eletrolisadas porque não conduzem corrente elétrica.
III. Nas eletrólises de soluções salinas, os cátions metálicos sofrem oxidação.
Podemos afirmar que apenas:
a) I é correta.
b) II é correta.
c) III é correta.
d) I e II são corretas.
e) II e III são corretas.
ALTERNATIVA “D”.
Nas eletrólises, os cátions sofrem redução, e não oxidação. Além disso, em soluções aquosas, o H3O+ descarrega primeiro que os cátions metálicos, porque ele é menos reativo.
2-(UFRS) Na eletrólise de nitrato de ferro II, em solução aquosa, ocorre:
a) redução no polo negativo com formação de ferro metálico.
b) oxidação no polo negativo com liberação de gás oxigênio.
c) redução no polo positivo com liberação de gás oxigênio.
d) oxidação no polo positivo com formação de gás NO2.
e) redução no polo negativo com formação de gás hidrogênio.
ALTERNATIVA “A”.
No polo negativo (cátodo da eletrólise), ocorre redução dos cátions:
Fe2+(aq) + 2 e- → Fe(s)
3-
A eletrólise ígnea do brometo de magnésio é representada pela equação química a seguir:
MgBr2(l) → Mg(s) + Br2(g)
Pode-se afirmar que, durante essa eletrólise:
a) há liberação de energia elétrica.
b) os íons Mg2+ oxidam-se.
c) os íons Mg2+ reduzem-se.
d) o eletrodo em que é formado magnésio metálico é o cátodo.
ALTERNATIVA “C”.
Na eletrólise ígnea do brometo de magnésio, ocorrem as seguintes semirreações:
Cátodo: Redução: Mg2++ 2 e- → Mg
Ânodo: Oxidação: 2 Cl–→ Cl2 + 2 e-
a) Falsa. Em toda eletrólise há absorção e não liberação de energia elétrica.
b) Falsa. Os íons Mg2+ oxidam-se.
c) Verdadeira. Os íons Mg2+ reduzem-se.
d) Falsa. O eletrodo em que é formado magnésio metálico é o cátodo
fonte: HTTP://WWW.COCEMSUACASA.COM.BR
fonte: HTTP://WWW.SOQ.COM.BR ; HTTPS://EXERCICIOS.BRASILESCOLA.UOL.COM.BR/
 |
| imagem: Brasil Escola UOL |