CONCEITO:
Segundo a Teoria da dissociação iônica de Arrhenius, uma substância é considerada ácida se, em meio aquoso, ela liberar como único cátion o H+ (ou H3O+).
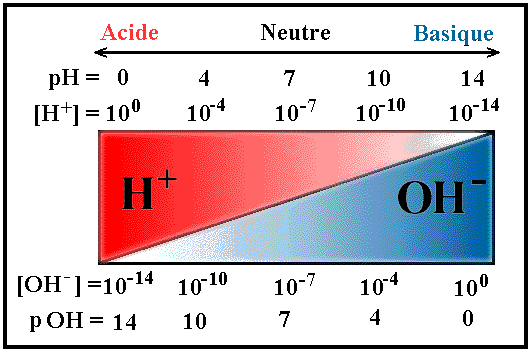
Quanto maior a quantidade desses íons no meio, maior será a acidez da solução. O pH é a sigla usada para potencial (ou potência) hidrogeniônico, porque se refere à concentração de [H+] ( lembre que essa notação significa mol/litro) (ou de H3O+) em uma solução. Assim, o pH serve para nos indicar se uma solução é ácida, neutra ou básica.
A escala de pH varia entre 0 e 14 na temperatura de 25ºC. Se o valor do pH for igual a 7 (pH da água), o meio da solução (ou do líquido) será neutro. Mas se o pH for menor que 7, será ácido, e se for maior que 7, básico.

Valores de pH para soluções ácidas, neutras e básicas Observe que quanto menor o valor do pH, mais ácida a solução será. Por definição : pH = – log [H+]
pOH = – log [ OH-]
Lembrete: pH + pOH = 14
 |
| imagem: Planejativo |
EXERCÍCIOS :
1) (UnB-DF) Os sistemas químicos baseiam-se em algumas características. Os sistemas ácidos caracterizam-se pela liberação de íon hidrônio,H3O1+(aq). Os sistemas básicos baseiam-se na liberação de íon hidroxila, OH -(aq). A tabela a seguir mostra a característica de alguns sistemas.

Considerando os sistemas citados, 100% ionizados, julgue os itens abaixo.
0. Todos os sistemas são formados por substâncias ácidas.
1. O pOH da saliva é igual a 6.
2. O vinagre é mais ácido que a clara de ovo.
3. O pH do vinagre é igual a 3.
4. Acrescentando uma gota de vinagre a uma gota de saliva, a solução se tornará neutra Resolução: Antes de qualquer coisa, calcule o pH de todas as substancias envolvidas:
| Vinagre: pH = – log [10-3] pH = – (-3) pH = 3 |
Saliva: pH = – log [10-6] pH = – (-6) pH = 6 |
Clara de ovo: pH = – log [10-8] pH = – (-8) pH = 8 |
agora respondendo:
0- FALSO porque a clara de ovo é básica ( pH maior que 7 )
1- FALSO – pH + pOH = 14 => pOH = 14-6 = 8 ( pOH da saliva é 8 ) 2- VERDADEIRO – pH do vinagre é 3 e o pH da clara de ovo é 8 .
3- VERDADEIRO – como visto acima
4- FALSO- adicionando duas substancias ácidas, a acidez aumenta .
2) (UFPE) A concentração hidrogeniônica do suco de limão puro é 10-3 mol/L. Qual o pH de um refresco preparado com 20 mL de suco de limão e água suficiente para completar 200 mL?
a) 2,5 b) 3,0 c) 3,5 d) 4,0 e) 4,5
Resolução: Lembre que concentração hidrogeniônica se refere à quantidade de H+ , em mol/ litro. A concentração hidroxiliônica se refere à quantidade de OH-, em mol/ litro.
– para fazer o cálculo do pH do refresco preparado é preciso descobrir quanto ficou, em mol, de suco de limão depois de feito o refresco. Foram utilizados 20 mL de suco de limão.
Qual a concentração molar dessa quantidade?
10-3 mol —————–> 1 litro = 1000mL
x—————————> 20 mL
em 20 mL temos 2 . 10-5 mol de suco de limão .
Como só foi adicionado água, a molaridade fica 2 . 10-5 mol em 200 mL
Para o cálculo do pH, precisamos de mol/ litro:
2 . 10-5 mol ———-> 200 mL
x ———————–> 1000mL ( 1 litro )
logo: x = 10-4 mol / litro
calculando o pH = – log [ H+]
pH = – log [ 10-4 ]———-> pH = 4
alternativa D
Se você não sabe trabalhar com logaritmos, corre atrás! Para esses exercícios, onde não há “número” na frente do 10, o pH é o elevado do 10 positivo: – log 10-4 ⇒ = 4
3) (UDESC 2009)
“Chuva ácida” é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal. Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis. O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5.
Considerando que a acidez está relacionada com a concentração de H3O+, é correto afirmar que a água com pH 4,5 era:
| A) | duas vezes mais básica que o normal. |
| B) | duas vezes mais ácida que o normal. |
| C) | dez vezes mais básica que o normal |
| D) | dez vezes mais ácida que o normal. |
| E) | cem vezes mais ácida que o normal. |
pH = 4,5 significa concentração de [H+] = 10– 4,5 mol/ litro
pH = 5,5 significa concentração de [H+] = 10– 5,5 mol / litro
A diferença entre as duas: pH = 4,5 é dez vezes mais ácida que pH = 5,5
10– 5,5 —— 10– 4,5 = 10– 5,5 – ( – 4,5) = 10 -1
alternativa D
fontes: HTTP://EXERCICIOS.MUNDOEDUCACAO.BOL.UOL.COM.BRHTTP://WWW.INFOESCOLA.COM.B
Para quem quiser assistir :