OI, GALERA !
Em 1913, Niels Bohr deu uma melhorada no modelo atômico proposto por Rutherford. Nesse modelo os átomos estão distribuídos em camadas ao redor do núcleo. Mas à medida que as camadas se afastam do núcleo, maior é a energia dos elétrons. A capacidade de absorção energética- os elétrons absorvem energia !- ainda possibilita o salto para um nível mais afastado do núcleo (estado ativo ou excitado) e a emissão de radiação quando retornam ao seu estado fundamental (estável e de menor energia).

No modelo atômico de Bohr, a energia entre as camadas eletrônicas é crescente.
Isso significa que quanto mais distante, maior é a capacidade energética. (Imagem: Pixabay)
Agora, conhecendo esse átomo, vamos entender como ele funciona. O átomo não fica parado. Está sempre em movimento. Tem um núcleo denso, composto de prótons ( cargas positivas ) e nêutrons ( sem carga ) ; e uma eletrosfera, grande e vazada onde elétrons ( cargas negativas) extremamente pequenos giram ao redor de maneira organizada, em órbitas, de acordo com a energia de cada um.
E CADA ÁTOMO TEM DUAS INFORMAÇÕES IMPORTANTES: NÚMERO ATÔMICO E NÚMERO DE MASSA.
-NÚMERO ATÔMICO= INDICA O NÚMERO DE PRÓTONS DE UM ÁTOMO. SENDO UM ÁTOMO NEUTRO, O NÚMERO DE PRÓTONS E O NÚMERO DE ELÉTRONS É IGUAL. SE O ÁTOMO TEM 27 PRÓTONS, TERÁ 27 ELÉTRONS.REPRESENTAMOS PELA LETRA Z.
-NÚMERO DE MASSA= INDICA O “PESO” DO NÚCLEO DO ÁTOMO. DENTRO DO NÚCLEO TEM PRÓTONS E NEUTRONS. SOMANDO ESSAS DUAS QUANTIDADES, TEMOS O NÚMERO DE MASSA, OU SEJA, A MASSA DESSE ÁTOMO. UM ÁTOMO QUE TEM 10 PRÓTONS E 15 NEUTRONS TERÁ UMA MASSA DE 25. REPRESENTAMOS PELA LETRA A
Então cada átomo tem sua identidade representada por dois números: número atômico Z e número de massa A:

Você pode perguntar se cada átomo é único, tem um determinado número de massa e um determinado número atômico.
Como estamos no campo da química, sempre tem um “pode ser”…
Se houver mais de um átomo com o MESMO NÚMERO ATÔMICO, temos os chamados ISÓTOPOS- ÁTOMOS QUE POSSUEM O MESMO NÚMERO ATÔMICO E DIFERENTE NÚMERO DE MASSA.

Observe a figura acima- são todos átomos de hidrogênio, que possuem o mesmo número atômico ( 1 ) e diferentes números de massa.
E CHEGAMOS AO CONCEITO DE ELEMENTO QUÍMICO: CONJUNTO DE ÁTOMOS QUE POSSUEM O MESMO NÚMERO ATÔMICO!
Agora, se os átomos tiverem o mesmo número de massa? Nesse caso são chamados de ISÓBAROS – ÁTOMOS QUE POSSUEM O MESMO NÚMERO DE MASSA, MAS DIFERENTE NÚMERO ATÔMICO!
veja abaixo: os dois átomos tem número de massa = 40 ;mas diferentes números atômicos, o que significa que são átomos totalmente diferentes.

E tem átomos com o mesmo número de nêutrons? Claro!
SÃO ISÓTONOS – ÁTOMOS QUE POSSUEM O MESMO NÚMERO DE NEUTRONS!!
Quer saber como encontrar o número de nêutrons? Fácil!!
A – Z = N ( NÚMERO DE MASSA – NÚMERO ATÔMICO = NÚMERO DE NEUTRONS !!! )
A ESTABILIDADE DE UM ELEMENTO QUÍMICO :
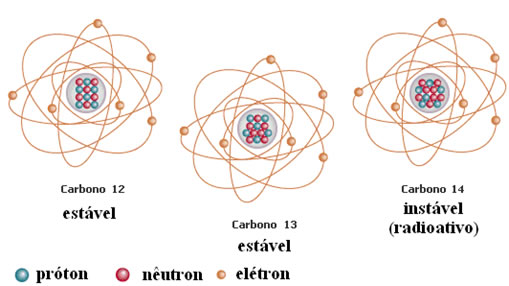
Veja, na figura abaixo, que o carbono tem 2 isótopos. E a estabilidade do elemento químico carbono ( que reune as três formas) é dada pelo carbono que tem em maior quantidade na natureza- nesse caso o carbono de massa = 12. Anote: estabilidade está ligada à maior quantidade desse átomo no elemento químico.
Você agora conhece as principais definições que movimentam o mundo dos átomos. Sendo assim, nosso próximo encontro será de exercícios, usando essas definições. Aguarde, que semana que vem tem mais fundamentos com exercícios que são figurinhas muito encontradas nos vestibulares!
Até lá!