ISOMERIA ÓPTICA
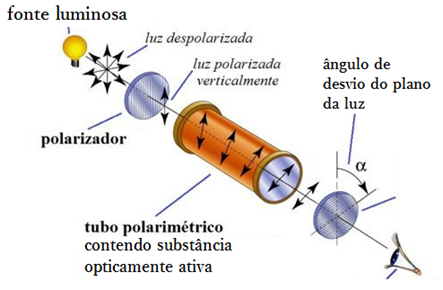
Isomeria Óptica é o tipo de Isomeria espacial que é caracterizada pelo desvio que os compostos químicos apresentam quando expostos a um plano de luz polarizada.
Isso quer dizer que há substâncias orgânicas que têm a mesma fórmula molecular, mas que diferenciam-se pelo seu comportamento óptico em decorrência da exposição à luz.
Essas substâncias são chamadas de isômeros opticamente ativos.
Um isômero opticamente ativo quando submetido à luz polar pode se comportar da seguinte forma:
- A luz pode ser desviada para a direita. Nesse caso, essa substância é chamada de dextrogira, de dexter (direito em latim).
- A luz pode ser desviada para a esquerda. Nesse caso, essa substância é chamada de levogira, de laevus (esquerdo em latim).
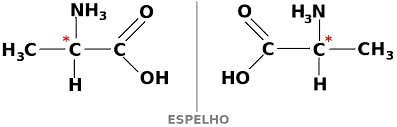
Quando uma substância se comporta das duas formas citadas acima, ou seja, para a direita e para a esquerda, ela recebe o nome de enantiômero.
Os enantiômeros apresentam uma estrutura que se assemelha a uma imagem refletida num espelho, as quais não são sobreponíveis e, sim, especulares.
Por outro lado, se a luz não for desviada, quer dizer que sua atividade óptica é inativa.
Isso acontece quando há misturas de dextrogira e levogira em partes iguais, as quais recebem o nome de misturas racêmicas.
CONDIÇÕES PARA A OCORRÊNCIA DE ISOMERIA ÓPTICA:
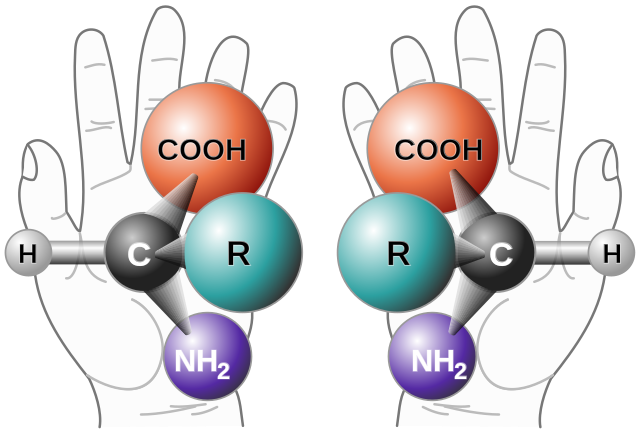
Há isomeria óptica quando o composto contém pelo menos um carbono assimétrico (C*), também chamado de carbono quiral.
O carbono assimétrico possui 4 ligantes diferentes, tal como mostra a imagem abaixo, em que não há substâncias iguais em torno do carbono:
MISTURA RACÊMICA
A mistura em quantidades iguais dos isômeros dextrogiro e levogiro resulta em uma mistura racêmica, também chamada racêmico. O racêmico é uma mistura opticamente inativa, não causando desvio no plano de vibração da luz. Isso ocorre porque o desvio gerado pelo levógiro é compensado ou anulado pelo desvio gerado pelo dextrogiro.
Segue abaixo alguns exemplos de moléculas que apresentam um carbono quiral, sendo, portanto, representados por um par de antípodas ópticas e um racêmico:
Observe a imagem a baixo:
NÚMERO DE ISÔMEROS OPTICAMENTE ATIVOS:
Podemos calcular a quantidade de isômeros opticamente ativos (ou seja, isômeros que desviam o plano da luz polarizada) de uma substância com base na quantidade de carbonos assimétricos (n) presentes na molécula, bem como na fórmula 2n.
Quando temos apenas um carbono assimétrico na fórmula estrutural, a substância apresenta apenas dois isômeros opticamente ativos, o dextrogiro e o levogiro, que desviam a luz em sentidos opostos, mas com o mesmo ângulo de inclinação.
Quanto mais carbonos assimétricos na molécula, maior a possibilidade de isômeros possíveis para essa. Vejamos o exemplo do aspartame:
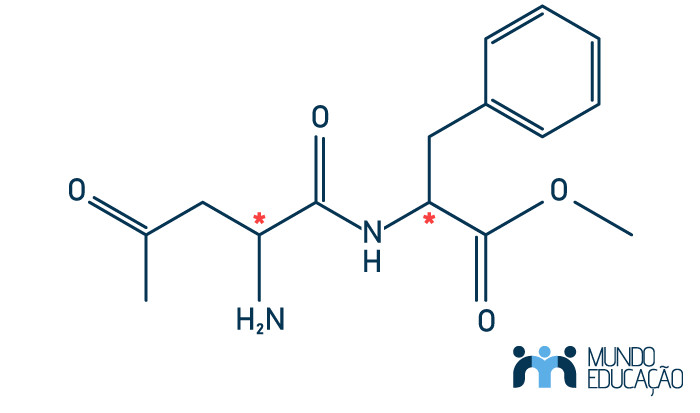
Por possuir dois carbonos assimétricos (indicados pelo asterisco), será possível encontrar quatro isômeros opticamente ativos para a substância em questão.
Lembre que o carbono quiral é aquele que possui quatro ligantes diferentes!!!
Exercícios resolvidos:
Questão 1 — (Unitau) O lactato apresenta isômeros denominados L- (+) ou D-(–) (estruturas abaixo representadas).
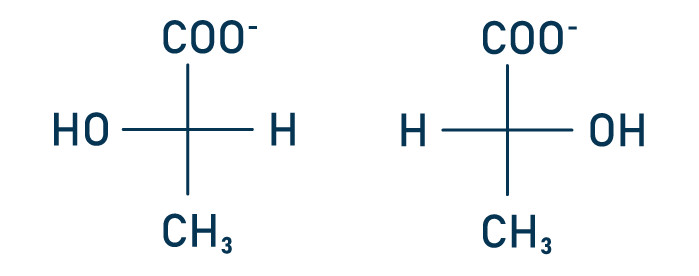
Isso é possível porque o lactato apresenta um carbono assimétrico, que confere à molécula a propriedade de desviar o plano da luz polarizada. O L-(+)-lactato desvia a luz no sentido horário (+), e o D-(–)-lactato, no sentido anti-horário (–). Antigamente, os sinais (+) e (–) eram representados pelas letras d e l, indicando dextrorrotatório e levorrotatório, respectivamente. O metabolismo humano produz L-(+)-lactato, enquanto o das bactérias produz D-(–)-lactato. Portanto, a presença de D-(–)-lactato no sangue e em outros fluidos corporais pode indicar infecção bacteriana. A quantificação desses isômeros é utilizada em vários estudos, como, por exemplo, os da área de ginecologia.
Com relação à isomeria, assinale a alternativa INCORRETA.
a) No lactato, o carbono quiral é o carbono do grupo carboxila.
b) Os dois isômeros de lactato são isômeros ópticos.
c) A mistura, em partes iguais, dos dois isômeros produz uma mistura racêmica.
d) Os isômeros de lactato não apresentam isomeria geométrica.
e) O número total de isômeros ópticos é 2n, sendo n = número de carbonos assimétricos.
Resolução:
A alternativa A está incorreta porque o carbono assimétrico (quiral) não é o carbono do grupo carboxila e sim o carbono tetraédrico presente no centro da molécula, indicado pelo asterisco.
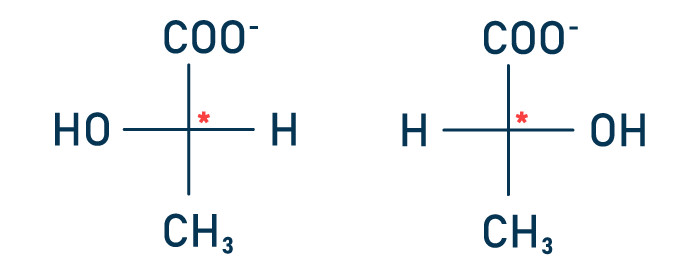
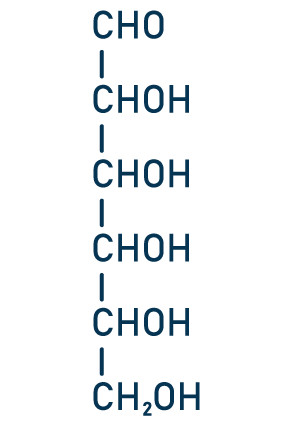
Questão 2 — (Unioeste-PR) Os açúcares pertencentes à família dos carboidratos são polidroxialdeídos ou polidroxicetonas, como ilustrado na figura abaixo. Essas estruturas apresentam carbonos quirais e podem ser encontradas na natureza nas mais diferentes formas isoméricas.
Considerando-se um açúcar com seis carbonos, ou seja, uma hexose, como representado na figura abaixo, o número máximo de estruturas estereoisoméricas possíveis de serem encontradas será de
a) 02
b) 04
c) 06
d) 08
e) 16
Resolução:
Para calcular o número de isômeros ópticos que possui a molécula, precisamos identificar a quantidade de carbonos assimétricos presentes na estrutura.
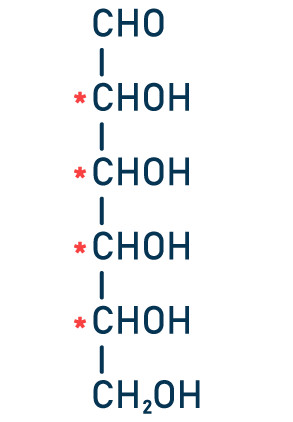
Os quatro carbonos indicados pelo asterisco são carbonos assimétricos. Com isso, podemos calcular a quantidade de isômeros ópticos a partir da fórmula , 2n, sendo n a quantidade de carbonos assimétricos: (2n = 24 = 16). A resposta correta, portanto, é a letra e.
Questão 3 — (Enem) Várias características e propriedades de moléculas orgânicas podem ser inferidas analisando sua fórmula estrutural. Na natureza, alguns compostos apresentam a mesma fórmula molecular e diferentes fórmulas estruturais. São os chamados isômeros, como ilustrado nas estruturas.
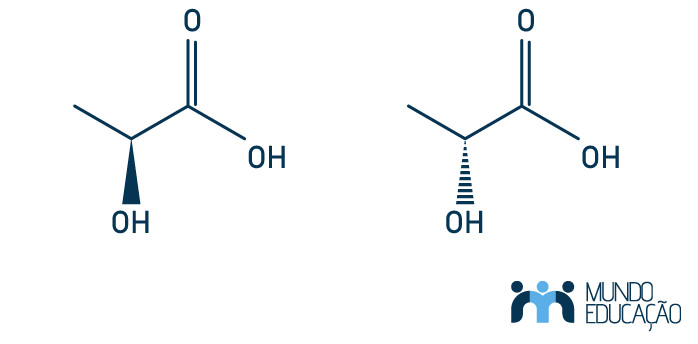
Entre as moléculas apresentadas, observa-se a ocorrência de isomeria
a) ótica.
b) de função.
c) de cadeia.
d) geométrica.
e) de compensação.
Resolução:
As moléculas apresentadas são classificadas como isômeros ópticos, uma vez que apresentam carbono assimétrico (que está ligado à função álcool) e não se enquadram nas outras classificações de isômeros, pois não apresentam diferenças constitucionais (isômeros planos) e nem carbonos sp2 que possibilitem classificá-las como isômeros geométricos (letra e)
Dúvidas? Assista ao resumo!
pesquisa: https://mundoeducacao.uol.com.br, https://vestibulares.estrategia.com, https://www.todamateria.com.br , Canal Xquimica