⇿←⇿ALÔ PESSOAL!
Nessa semana trabalhando com o diagrama de Linus Pauling para a distribuição de elétrons .
Como assim?
Vamos lembrar de algumas regras básicas:
– o átomo possui um núcleo: nesse núcleo tem prótons ( positivos ) e nêutrons.
– o átomo possui uma eletrosfera que gira ao redor do núcleo: essa eletrosfera é composta por elétrons ( negativos) .
– se estamos falando de um átomo, sua carga é nula, ou seja o número de prótons é igual ao número de elétrons.
– se estamos falando de íons , eles podem ser positivos- quando são retirados elétrons – ou íons negativos- quando são adquiridos elétrons.
De qualquer forma, veja que todo o processo ocorre na eletrosfera , não se mexe no núcleo de um átomo.
As ligações químicas, iônicas ou covalentes, ocorrem na eletrosfera.
E para saber tudo isso tem que começar por alguma lugar e esse lugar é o diagrama de Pauling que vai dizer quantos elétrons tem na última camada, essencial para qualquer ligação.
Para você entender a distribuição eletrônica tem duas maneiras: ou aceita e faz, ou tenta entender o conceito.
Conceito: cada camada eletrônica ( K L M N O P Q ) tem subcamadas, ou subniveis que são os orbitais. Esses orbitais são locais onde você pode encontrar o elétron. Não esquece que ele não fica parado, esta sempre em movimento.
Esses orbitais são : s, p, d, f . Cada um deles aguenta um número máximo de elétrons.
s=2 elétrons
p=6 elétrons
d=10 elétrons
f=14 elétrons
O orbital f é o mais forte, depois vem o d, p, e o s
Logo o diagrama foi construído nessa força.
Por isso ele é usado na diagonal, porque assim pega os mais fortes primeiro e depois os mais fracos.
E o que vamos distribuir? o número atômico , que é igual ao número de elétrons.
Diagrama de Pauling: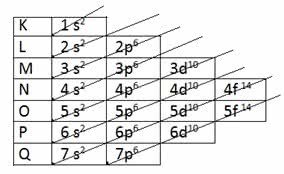
Você esta vendo essa linhas diagonais? Então, é por elas que você vai se guiar.
Segue comigo:
Vamos distribuir os elétrons do cálcio de Z = 20.
1s2,2s2,2p6,3s2,3p6,4s2 = somando os números rosa = número de elétrons dá 20 e seguimos as linhas diagonais do diagrama acima começando pelo 1s2, depois volta para o 2s2….
Veja que a última camada, o ultimo número que escrevemos foi 4, depois a letra s com 2 elétrons.
4= ultima camada , s = último orbital que contém 2 elétrons
Na última camada tem 2 elétrons. Você já descobriu uma coisa muito importante: o cálcio é um elemento que tem 2 elétrons na última camada!
Vejamos outro exemplo: Oxigênio que tem Z = 8
Seguindo o diagrama:
1s2, 2s2, 2p4 ——–> observe que o ultimo número foi alterado porque 6 iria ultrapassar. Isso podemos fazer , adequar o último número de acordo com o que precisamos!
Nesse caso quantos elétrons tem na última camada? presta atenção!!!
A última camada é a que tem o número 2 na frente ,2s2,2p4 = 6 elétrons na última camada.
Quando você tem mais de um orbital na mesma camada, tem que somar todos os elétrons que pertencem a essa camada!
Exercício:
Dê o número de elétrons na última camada do elemento Kr que tem Z = 36
1s2, 2s2, 2p6, 3s2, 3p6 .4s2, 3d10, 4p6 – seguindo o diagrama você sai do 4s2 e vai para o 3d10 que tem mais energia que 4p6 que vem depois!
A última camada é 4( número mais longe do núcleo!) mas tem : 4s2 e 4p6 logo: 8 elétrons na última camada!
E para que serve saber o número de elétrons na última camada?
Através desses números você vai saber que tipo de ligação o átomo vai fazer e como fazer!
E se forem íons? como fica a distribuição?
Íons positivos como Ca +2 = significa que perdeu 2 elétrons .
sua distribuição eletrônica vai ficar assim:
⇿1s2,2s2,2p6,3s2,3p6= veja acima, a última camada foi embora junto com os 2 elétrons!
Íons negativos como O-2 = significa que ganhou 2 elétrons.
Sua distribuição eletrônica vai ficar assim:
⇿1s2, 2s2, 2p6 = veja que na última camada ele ganhou 2 elétrons ficando com 8!
Dúvidas? Perguntem!
