ALÔ PESSOAL!
Vamos ao básico, diagrama de Linus Pauling.
Ou distribuição eletrônica.
Ou distribuição dos elétrons por camada e subnível.
Entendeu?
O Diagrama de Pauling, também conhecido como Diagrama de Energia, é a representação da distribuição eletrônica através de subníveis de energia.
Através do esquema, o químico Linus Carl Pauling (1901-1994) sugeriu algo além do que já havia com relação à distribuição de elétrons dos elementos químicos.
Para melhor organizar os átomos, Pauling propôs subníveis de energia. Através deles, seria possível determinar os elétrons do menor aos de maior energia de um átomo no seu estado fundamental.
De acordo com a distribuição eletrônica, a eletrosfera está dividida em 7 camadas eletrônicas (K, L, M, N, O, P e Q) ao redor do núcleo atômico, sendo que cada uma delas permite um número máximo de elétrons, que são 2, 8, 18, 32, 32,18 e 8, respectivamente.
Pauling, então, acrescentou ao processo de distribuição de eletrônica os subníveis, apresentando primeiro o elétron de menor energia até chegar ao elétron de energia maior.
Conceito de orbital:
Região de maior probabilidade de se encontrar o elétron.
Tipos de orbitais:
s – esférico, ao redor do núcleo, tem até 2 elétrons em sua órbita.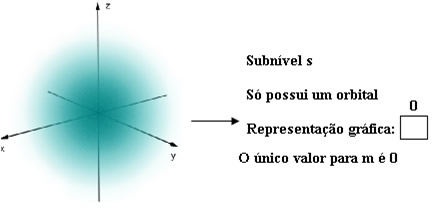

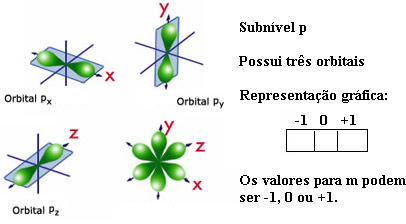
p- em forma de halteres, tem até 6 elétrons em suas órbitas .
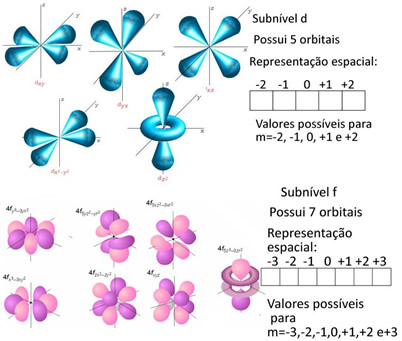
d- mais complexo, tem até 10 elétrons em suas órbitas.
f- bem mais complexo, tem até 14 elétrons em suas órbitas.
Representação:
s2 p6 d 10 f 14
DIAGRAMA DE PAULING:
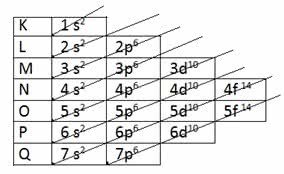
Exemplo de distribuição eletrônica:
em átomos:
P ( Z = 15)
1s2 2s2 2p6 3s2 3p3 tem 6 elétrons na última camada
em íons:
O – 2 ( significa que o Oxigênio ganhou 2 elétrons ) Se o número atômico é 8, então tem 8 elétrons no elemento oxigênio.
No íon oxigênio – 2 temos 10 elétrons:
1S2 2S2 2P6
Próxima postagem: Números quânticos !
fontes: www.mundoeducacao.com.br
