ALÔ PESSOAL!
Viram a Teoria no post passado e agora vamos fazer exercícios!
Lembre sempre: quando aplicamos aprendemos melhor!
1) Qual o número de massa (A) de um átomo de cálcio (Z = 20) com 20 nêutrons?
R: A = p + n ( por definição o número de prótons é o número atômico representado pela letra Z.)
A= 20 prótons + 20 nêutrons = 40
2) O número atômico (Z) e o número de massa (A) de um íon monoatômico com carga 3+ que contém 10 elétrons e 14 nêutrons são:
R: Se a carga do íon é + 3 significa que perdeu 3 elétrons. Logo o número de elétrons do átomo é 13.Como em um átomo o número de prótons é igual ao número de elétrons, Z=13
Para saber a massa :
A = 13 + 14 nêutrons = 27.
3) Dentre as espécies químicas:
as que representam átomos cujos núcleos possuem 6 nêutrons são: R: Os átomos que tiverem 6 nêutrons são átomos isótonos. O número de nêutrons se conhece através da subtração:
A-Z , ou seja, massa- número atômico.
Na sequencia do B temos: 9-5= 4 nêutrons; 10- 5= 5 nêutrons; 11- 5= 6 nêutrons
Na sequencia de C temos: 10- 6= 4 nêutrons; 12-6= 6 nêutrons; 14-6= 8 nêutrons.
Os átomos que possuem 6 nêutrons no núcleo são: 5B11 6C12
4) O número de prótons, nêutrons e elétrons representados por 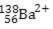 é:
é:
O bário é um íon positivo, logo perdeu 2 elétrons, mas seu número atômico e seu numero de massa não se alteram.
Logo esse íon terá 138- 56 = 82 nêutrons , 56 prótons e 54 elétrons.
5) Determine o número atômico e o número de massa dos átomos A e B, que são isóbaros e apresentam a seguinte representação:
