A CINÉTICA QUÍMICA ESTUDA A VELOCIDADE DAS REAÇÕES QUÍMICAS E OS FATORES QUE ALTERAM ESTA VELOCIDADE.
REAÇÕES QUÍMICAS SÃO O RESULTADO DE AÇÕES ENTRE SUBSTÂNCIAS QUE GERALMENTE FORMAM OUTRAS SUBSTÂNCIAS.
O que determina a rapidez com que ocorre uma reação química é o tempo em que os reagentes são consumidos para formar produtos. Assim, a velocidade de uma reação pode ser representada tanto pelo consumo de um reagente, quanto pela geração de um produto.
Antes de acontecer a reação química, temos quantidade máxima de reagentes e nenhum produto. Quando um dos reagentes é totalmente consumido, formam-se os produtos e a reação termina.
PRIMEIRO VOCÊ PRECISA SABER SE, DE FATO, ELA VAI OCORRER!!!
As reações podem ser lentas , moderadas ou rápidas:

CONDIÇÕES PARA QUE UMA REAÇÃO OCORRA:
E QUAIS SÃO AS CONDIÇÕES?
1– OS REAGENTES TEM QUE ESTAR EM CONTATO! MEIO OBVIO NÃO?
2- ELES PRECISAM COLIDIR, OU SEJA , ” BATER” UM NO OUTRO PARA QUE SE ROMPAM AS LIGAÇÕES DOS REAGENTES E SE INICIEM A FORMAÇÃO DOS PRODUTOS.
3- ESSAS COLISÕES TEM QUE SER EFETIVAS, PRODUZINDO RESULTADOS, DO JEITO CERTO. VEJA NO ESQUEMA ABAIXO!

Quando as colisões ocorrem existe um estado intermediário, o complexo ativado, ONDE JÁ NÃO HÁ REAGENTES E OS PRODUTOS AINDA NÃO SE FORMARAM.
TUDO ESTÁ SEPARADO! ⇓
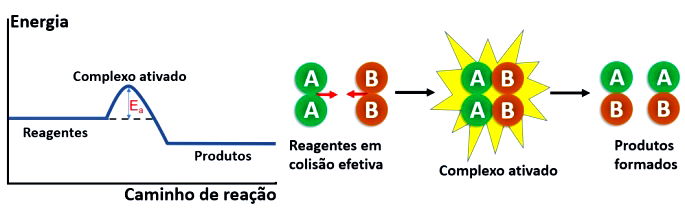
Para que ocorra a formação do complexo ativado, as moléculas dos reagentes devem apresentar energia suficiente para que ocorra a reação: chama-se energia de ativação.(Ea)- TIPO UM EMPURRÃO PARA QUE AS MOLÉCULAS COMECEM A SE MEXER!

imagem:cola da web
Tanto as reações endotérmicas ( absorvem calor) quanto as exotérmicas ( liberam calor) formam o complexo ativado.
 |
| imagem:s2.glbimg.com |
Também há fatores que podem influenciar a velocidade das reações:

- Concentração: quando maior a quantidade de reagentes, maior a possibilidade de colisões.
- Temperatura: aumento de temperatura, aumenta a agitação das moléculas, aumenta a possibilidade de colisões.
- Superfície de contato: quanto maior ela for, maior a possibilidade de colisões, logo quanto mais “dividido” estiverem os regentes, mais rápida a velocidade.
- Luz: aumenta a energia cinética das moléculas dos reagentes.
- Catalisadores são substancias capazes de aumentar a velocidade da reação sem participarem dela, ou seja, não são consumidas durante a reação.
Se você quiser, veja o vídeo explicativo no CANAL XQUIMICA .
No próximo post, exercícios sobre essa teoria !

