DEFINIÇÕES IMPORTANTES:
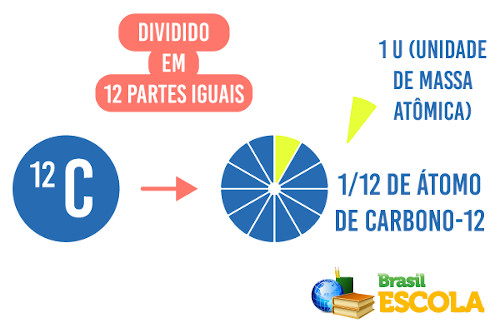
A massa atômica é a massa de um átomo ou de um elemento químico em relação a 1/12 da massa de um átomo de carbono-12. A massa atômica é a massa de um átomo medida em unidade de massa atômica, sendo simbolizada por “u”.
Pense que cada átomo da tabela periódica foi “pesado” e comparado com a massa de 1/12 do carbono 12.
É como pegar uma pizza, cortar em 12 pedaços e colocar em uma balança. Vamos supor que deu 10 gramas.
Agora vamos pesar uma banana e temos 50 gramas, o que corresponde a cinco pedaços da pizza.
Nesse caso a banana vale 5 unidades de pizza.
A mesma ideia foi usada para fazer o cálculo da massa de todos os elementos químicos, a MASSA ATÔMICA.
Mol é uma quantidade que pode ser visualizada. Você não pode ver um átomo de ferro, mas com certeza, um mol de ferro poderá ser visto.
Mas o que isso significa?
Foi estabelecido que um mol é uma determinada quantidade que corresponde a 6,02 x 1023 átomos, íons ou moléculas de uma substância.
Então um mol de ferro possui 6,02 x 1023 átomos de ferro.
.jpg)
A massa molar é a massa contida em 1 mol de substância. Para simplificar, a massa molar é a mesma massa atômica que você encontra na tabela periódica, só que o valor é em g/ mol.
No caso do ferro, sua massa atômica é 56 u, ou seja, ou seja 56 unidades de massa. “O PESO DE UM ÁTOMO” ou massa atômica, que está registrada na Tabela Periódica.
Agora, um mol de ferro são 56 g/ mol. O que significa que cada mol de ferro, cada “pacote” correspondente a um mol, tem 56 gramas. Se tiver 3 mol de ferro serão 3x 56 = 168g.
Para ficar mais elegante:
1 mol de ferro tem 6,0 x 1023 átomos de ferro e sua massa é de 56g/ mol –para agilizar os cálculos é usado o número 6,0 x 1023
3 mol de ferro tem 3×6,0 x 1023 átomos de ferro e sua massa é de 168g.
↓
18 x 1023
Exercício de base:
Unicid-SP) Um químico possui uma amostra de cobre (dado: 6429Cu). A massa, em gramas, dessa amostra, sabendo-se que ela é constituída por 3,01 . 1023 átomos, é:
a) 0,32 . 1023 g
b) 0,29 . 1023 g
c) 1,60 . 1023 g
d) 64,00 g
e) 32,00 g
Alternativa “e”.
A massa molar do cobre é igual a 64 g/mol e sabemos que 1 mol tem 6,0 . 1023 átomos, assim:
64 g —– 6,0 . 1023 átomos
m ——– 3,01 . 1023 átomos
m = 64 . 3,01 . 1023
6,0 . 1023
m = 192,64 . 1023
6,0 . 1023
m ≈ 32,00 g
IMPORTANTE:
6429Cu Lembre que nos exercícios, o número que aparece em cima do elemento é o número de massa 64, que é sempre maior que o número de baixo, que é o número atômico 29. |e quando se trata de massa, usamos sempre o número de cima!!!!
Pesquisas: Brasil escola Uol, Pre Para Enem,https://exercicios.brasilescola.uol.com.br

