ALÔ PESSOAL!
O assunto é extenso!
Ligações entre orbitais P :
Na ligação pi, temos a interpenetração dos orbitais atômicos incompletos no eixo paralelo. Por essa razão, ela só ocorre entre orbitais do tipo p. Dos três orbitais p, dois podem realizar ligação pi, o vertical e o diagonal. O horizontal é utilizado para representar a ocorrência da ligação sigma. Isso acontece porque apenas esse dois eixos podem ficar em paralelo com os mesmos eixos de outro átomo.
fonte: http://mundoeducacao.bol.uol.com.br

fonte:http://aprendendoquimicaonline.blogspot.com.br
HIBRIDIZAÇÃO:
Hibridização é a “mistura” de orbitais atômicos puros, que originam orbitais atômicos híbridos equivalentes entre si, porém diferentes dos orbitais puros originais.
Os elementos que apresentam hibridização são carbono, silício, enxofre, sendo que o mais conhecido é a hibridização do carbono:
A hibridização do carbono do tipo sp acontece somente quando ele realiza duas ligações pi (π) e duas ligações sigma (σ). Há, nesse caso, então, duas possibilidades: o carbono pode fazer duas ligações duplas ou uma ligação simples e uma tripla, conforme se observa a seguir:
A hibridização do carbono do tipo sp2 ocorre quando ele apresenta uma ligação dupla e duas ligações simples ou uma ligação pi (π) e três ligações sigma (σ). Na realidade, a hibridização sp2 é ocasionada entre os átomos que estabelecem a ligação dupla.
Um exemplo de molécula assim é a do formol (CH2O). Observe sua estrutura abaixo:
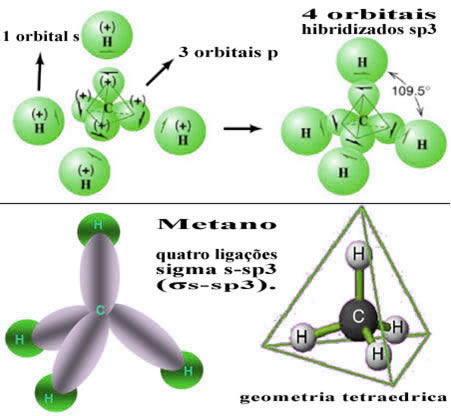
A Hibridização do carbono tipo sp3:
Esse tipo de hibridização ocorre na molécula do metano (CH4). Observe que são quatro ligações covalentes idênticas entre o carbono, que é o elemento central, e quatro hidrogênios.
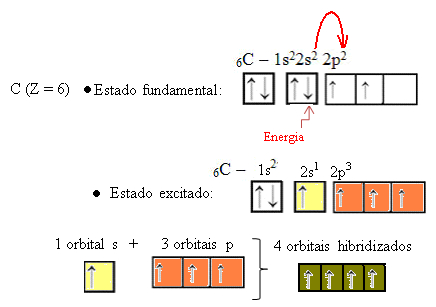
Quando um elétron do orbital 2s absorve energia, ele passa para o orbital 2p que está vazio. Assim, dizemos que esse salto do elétron do subnível 2s para o 2p é uma “promoção” do elétron. Desse modo, o carbono fica em seu estado excitado ou ativado, com quatro orbitais hibridizados, disponíveis para realizar as ligações covalentes:
Veja que os orbitais híbridos formados são equivalentes entre si, porém diferentes dos orbitais puros originais.(fonte:http://brasilescola.uol.com.br)
RESUMÃO :
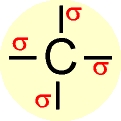 Hibridização sp3 ( ligações sigma)
Hibridização sp3 ( ligações sigma) 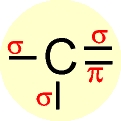 Hibridização sp2 ( 3 ligações sigma e uma pi)
Hibridização sp2 ( 3 ligações sigma e uma pi)  Hibridização sp ( 2 ligações sigma e 2 ligações Pi)
Hibridização sp ( 2 ligações sigma e 2 ligações Pi) fonte:http://www.algosobre.com.br

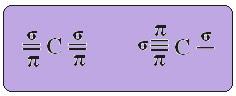
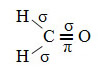
 Hibridização sp3 ( ligações sigma)
Hibridização sp3 ( ligações sigma)  Hibridização sp2 ( 3 ligações sigma e uma pi)
Hibridização sp2 ( 3 ligações sigma e uma pi)  Hibridização sp ( 2 ligações sigma e 2 ligações Pi)
Hibridização sp ( 2 ligações sigma e 2 ligações Pi) 