Quando temos um íon, a diferença será sempre no número de elétrons, ou seja, a massa e o número atômico do elemento não mudam. Não existe dois elementos diferentes com o mesmo número atômico.
Se tiverem o mesmo número atômico são chamados átomos ISÓTOPOS, ou seja, mesmo elemento químico na composição, com massas diferentes. Oxigênio–O2 — e Ozônio –O3 – são bons exemplos.
Ambos são elemento Oxigênio, mas um tem massa 32 u ( 2 átomos de oxigênio, cada um com 16 g/ mol) e outro tem massa 48 u ( 3 átomos de oxigênio com 16 g/ mol cada um ) , o que significa maior número de nêutrons, uma vez que o número de prótons não se altera.
O número atômico do oxigênio é 8. Então Z = 8 = 8 prótons , tanto na molécula de gás oxigênio como na molécula de gás ozônio.
Veja a configuração do carbono e seus isótopos: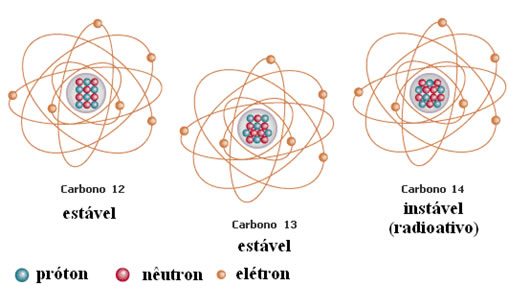
Agora, imagina que você tem dois átomos com o mesmo número de massa.
Assim como
20Ca40, 19K40, 18Ar40 são elementos diferentes, com números atômicos diferentes, mas com o mesmo número de massa. A = 40
Esses átomos são chamados ISÓBAROS.
Se o número de elétrons for o mesmo – e isso acontece entre átomos e íons- temos os átomos ISOELETRÔNICOS, como abaixo: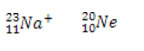 onde o íon positivo de sódio tem o mesmo número de elétrons do átomo de neônio.
onde o íon positivo de sódio tem o mesmo número de elétrons do átomo de neônio.
ISOTÓNOS : átomos com o mesmo número de nêutrons.
Para isso precisamos calcular o número de nêutrons de cada átomo pela diferença entre massa e número atômico ou seja: A – Z = N 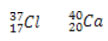 fazendo a diferença: 37 – 17 = 20 nêutrons no cloro
fazendo a diferença: 37 – 17 = 20 nêutrons no cloro
40 – 20 = 20 nêutrons no cálcio. Logo tem o mesmo número de nêutrons e são isoeletrônicos.
Quanto aos íons temos:
-ION POSITIVO = átomo que perde elétrons , como Na+1 significa que perdeu 1 elétron.
– ION NEGATIVO = átomo que ganha elétrons , com S -2 significa que ganhou 2 elétrons.
fontes: blog XQUIMICA e alunosonline.com.br
