ALÔ PESSOAL!!!!
Assunto importante e a chave para a resolução de pequenos mistérios!
Propriedades Coligativas são aquelas propriedades das substâncias puras que são modificadas quando se adiciona um soluto não volátil a elas.( o soluto não evapora)
Essas propriedades, portanto, não são explicadas pela natureza da substância, mas sim pela quantidade de suas moléculas, partículas ou átomos.
TONOSCOPIA:
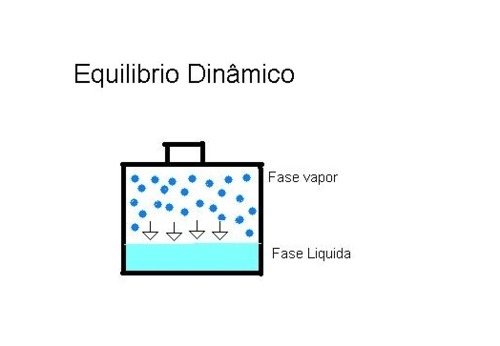
Também denominada de Tonometria, esta propriedade coligativa estuda a diminuição da pressão máxima de vapor de um solvente causada pela adição de um soluto não-volátil.
Quando um líquido entra para o estado de vapor, estabelece novas interações, sendo que a quantidade de solvente presente nesta nova fase vai determinar a chamada pressão de vapor. A pressão de vapor de uma solução corresponde à quantidade de solvente na fase gasosa e existe uma relação entre o abaixamento da pressão máxima de vapor e o número de mols do soluto presente em uma solução.
Quanto maior for o número de mols do soluto não-volátil na solução, maior será o abaixamento da pressão máxima de vapor.
Imagine que quanto maior for o número de moléculas de soluto dissolvidas, maior será a ” competição ” para evaporar o solvente. Assim a pressão de vapor vai diminuir uma vez que “demora” mais para o solvente evaporar e em menor quantidade.
Para fazer esse cálculo levamos em consideração a fração molar do solvente ( x2) :
Sabe-se que toda solução tende a um equilíbrio, e este pode ser atingido se considerarmos a Lei de Raoult: a pressão de vapor de um solvente em uma solução é igual ao produto da pressão de vapor do líquido puro presente nesta solução, se considerarmos a fração molar do líquido. Veja a fórmula que permite calcular esse princípio:
p2 = p0 • x2
Onde:
p2 = pressão de vapor do líquido na solução
p0 = pressão de vapor no líquido puro
x2 = fração molar do líquido na solução
O QUE É FRAÇÃO MOLAR?
A fração molar está relacionado com o número de mols do soluto e o número de mols do solvente da seguinte forma:
fração molar do soluto = X1 = X1 ——
X1 + X2
fração molar do solvente = X2 = X2 ——
X1 + X2
Temperatura crítica e pressão crítica:
A pressão de vapor de um líquido aumenta com o aumento da tempertura até certo ponto, ponto crítico.
Ele é estabelecido pelo par Tc ( temperatura crítica ) e Pc ( pressão crítica)
Nessa condições temos o fluido supercrítico ou gás supercrítico.
fonte: Brasil escola /estudo da química