AMINAS
Aminas
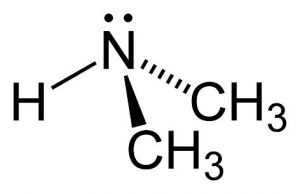
Derivadas da amônia (NH3), as aminas são os compostos em que os átomos de hidrogênio são substituídos por radicais alquila, ou seja, radicais dos alcanos, ou arila, aqueles derivados de um anel benzênico. Quando apenas um dos hidrogênios é substituído, a cadeia é classificada como uma amina primária. No caso de dois hidrogênios substituídos, amina secundária e três, terciária. Quando o átomo de hidrogênio é substituído por um radical arila, denominamos amina aromática.
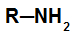 – amina primária
– amina primária
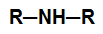 – amina secundária
– amina secundária
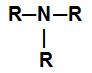 – amina terciária
– amina terciária
Para nomeá-las, é necessário observar quantos radicais existem na cadeia, esse número determinará o prefixo, que pode não existir no caso de somente um radical, ou pode ser di ou tri no caso de dois ou três radicais. Depois disso, é preciso analisar quantos carbonos há no radical e, de acordo com esse número, adicionaremos os nomes met, et, prop, but etc. Depois, as aminas sempre terão um “il” e o sufixo sempre será “amina”. No exemplo abaixo podemos observar que há dois radicais (di) com um carbono cada (metil), portanto chamamos dimetilamina.
“Exemplo 1: Amina primária
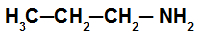
Na amina primária desse exemplo, temos a presença de uma radical propil, assim, o seu nome é propilamina.
Exemplo 2: Amina secundária
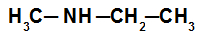
Na amina secundária desse exemplo, temos a presença do radical metil (à esquerda do nitrogênio) e do radical etil (à direita do nitrogênio). O seu nome é, seguindo a ordem alfabética, etil-metilamina.
Exemplo 3: Amina terciária
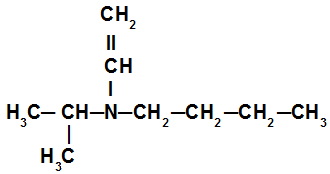
“Na amina terciária desse exemplo, temos a presença do radical isopropil (à esquerda do nitrogênio), do radical butil (à direita do nitrogênio) e do radical vinil (abaixo do nitrogênio). O seu nome é, portanto, butil-isopropil-vinilamina.”
APLICAÇÃO DAS AMINAS
Muito utilizadas na produção de vários compostos orgânicos;
Utilizadas na fabricação de sabões;
Utilizadas no processo de vulcanização da borracha;
Utilizadas na fabricação de corantes.
trimetilamina-

As aminas podem se apresentar em condições ambientes na forma sólida, líquida ou gasosa, dependendo de sua estrutura. Aminas alifáticas com até doze carbonos são líquidas, e as com mais de doze carbonos são sólidas, e todas elas são incolores. As líquidas são tóxicas e apresentam cheiro desagradável, e as sólidas são inodoras.
Aminas podem ser produzidas na decomposição de peixes (trimetilamina), e na decomposição das proteínas de organismos humanos putrefatos (cadáveres) são formadas a putrescina e cadaverina, essas são diaminas alifáticas saturadas. Alguns compostos extraídos de vegetais, tais como os alcalóides contêm amina em sua fórmula.

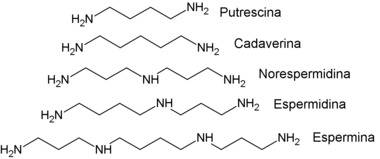
Em muitas sínteses orgânicas são utilizadas aminas, como por exemplo, na vulcanização da borracha, na preparação de corantes, na fabricação de sabões, na produção de medicamentos, etc.
Amidas
Já as amidas são os compostos em que o hidrogênio da amônia é substituído por um radical acila, ou seja, aquele que obtemos com a retirada da hidroxila de um ácido carboxílico. Neste caso teremos uma carbonila ligada ao nitrogênio.
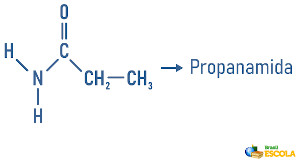
Para nomear uma amida devemos seguir o modelo dos hidrocarbonetos. O prefixo será composto de acordo com o número de carbonos da cadeia principal, a parte intermediária pelo tipo de ligações, porém o sufixo será “amida”. No exemplo abaixo podemos observar que há dois carbonos na cadeia principal (et), apenas ligações simples (an) e uma carbonila ligada a um nitrogênio (amida), logo esse composto será denominado etanamida.
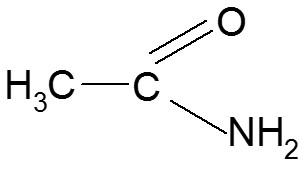
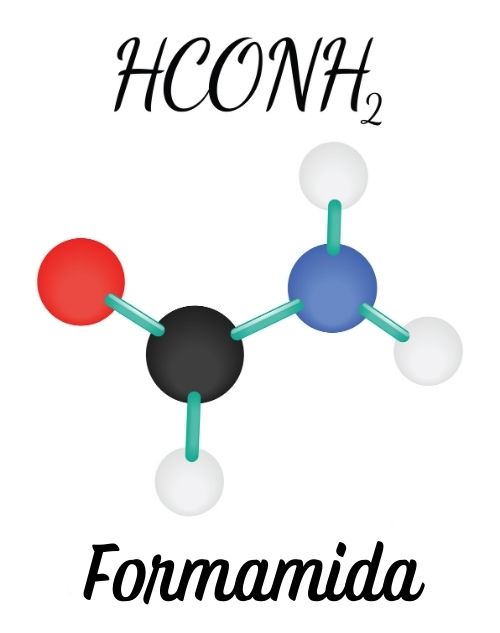
“São substâncias disponíveis de forma natural, uma delas é nas excretas dos mamíferos (ureia), mas podem ser obtidas também por síntese artificial.
As amidas podem ser produzidas, por exemplo, por desidratação do sal de amônio, processo utilizado na fabricação de polímeros. São utilizadas também como fertilizantes, devido a sua disponibilidade de nitrogênios, e como medicamento, tendo ação antimicrobiana.”
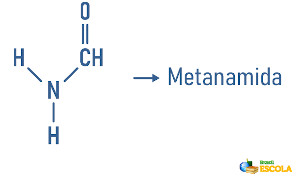
Classificação de acordo com o número de carbonilas ligadas ao nitrogênio
As amidas podem ser classificadas também de acordo com o número de carbonilas ligadas diretamente ao nitrogênio da molécula.
Amidas primárias: apenas um grupo acila ligado ao nitrogênio (R-CO)NH2 .
Amidas secundárias: duas carbonilas ou grupo acila ligado ao nitrogênio (R-CO)2NH.

Amidas terciárias: três grupos acilas ligados ao nitrogênio (R-CO)3 N
PROPRIEDADES DAS AMIDAS:
Elevado ponto de fusão e ebulição, que terá valor escalonado de acordo com o tamanho e arranjo espacial da cadeia carbônica.
Altamente polares, devido à presença da carbonila e do nitrogênio.
Amidas não substituídas e monossubstituídas realizam ligação de hidrogênio.
Moléculas menores e mais simples são solúveis em água. O tamanho da molécula interfere também na solubilidade das amidas: quanto maior a cadeia carbônica, menos solúvel elas serão em água.
As amidas têm caráter básico pela propensão a receberem íons H+.
APLICAÇÃO DAS AMIDAS
Utilizadas como intermediadoras na fabricação de polietilenos como nylon.
Aplicadas na formulação de medicamentos como a sulfanilamida e penicilina, princípios ativos de medicamentos bactericidas no controle de infecções.
A ureia que pode ser obtida de forma sintética ou como produto excretado por mamíferos, é uma substância do grupo amida, uma diamida. É utilizada como suplemento alimentar na agropecuária e como fertilizante.
Exercícios:
VÍDEO SOBRE AMINAS E AMIDAS:
pesquisas: https://mundoeducacao.uol.com.br; https://brasilescola.uol.com.br; Wikipédia, https://www.manualdaquimica.com,