ÉTER
Éteres são compostos orgânicos, ou seja, que são formados de átomos de carbono. Eles pertencem à função oxigenada e possuem oxigênio entre os átomos de carbono.
Apresentam como propriedades físicas o fato de serem encontrados nos estados líquido, sólido ou gasoso. São muito inflamáveis e possuem cheiro muito intenso.

NOMENCLATURA
A nomenclatura IUPAC (União Internacional de Química Pura e Aplicada, em português), é a utilizada para dar nomes oficiais aos éteres.
O primeiro passo, é indicar o número de átomos de carbono através do prefixo:
1 – met, 2 – et, 3 – prop, 4 – but, 5 – pent, 6 – hex, 7 – hept, 8 – oct, 9 – non, 10 – dec.
Em seguida, temos de identificar O OXIGÊNIO entre os carbonos e dividir o éter pelo LADO QUE TEM MENOS E MAIS CARBONO AO LADO DO OXIGÊNIO.
No lado do oxigênio que tem MENOR QUANTIDADE DE CARBONOS, ou seja, cuja cadeia é menor, o sufixo é -oxi. Enquanto isso, no lado COM MAIOR NÚMERO DE CARBONOS o sufixo é -ano.
Exemplo:
CH3 – O – CH2 – CH3
Do lado esquerdo do oxigênio, há apenas um átomo de carbono. Logo, o prefixo é met.
Do lado direito do oxigênio, são dois os átomos de carbono. Logo, o prefixo é et.
Assim, ao prefixo met (cadeia menor) é acrescido o sufixo -oxi, do qual resulta a palavra metoxi.
Ao prefixo et (cadeia maior) é acrescido o sufixo -ano, do qual resulta a palavra etano.
Juntos, formam o nome METOXI ETANO (CH3 – O – CH2 – CH3).
UTILIZAÇÕES DOS ÉTERES:
O éter, do grupo funcional dos éteres, tem a capacidade de dissolver substâncias. Assim, é utilizado em laboratórios como um solvente na extração de gorduras e também para dissolver graxas e tintas.
Os éteres são compostos incolores, de cheiro agradável e pouco solúvel em água, em condições ambientes podem se apresentar na fase sólida, líquida ou gasosa. Os de massa molecular mais elevada estão no estado sólido, os que apresentam dois e três carbonos na molécula são gasosos e os seguintes são líquidos que são extremamente voláteis.
O éter etílico (éter comum) pertence à classe de éteres, é um líquido incolor muito volátil (ferve a 35° C), produz frio intenso ao evaporar em contato com a pele e seus vapores são três vezes mais pesados que o ar.

CH3 – CH2 – O – CH2 – CH3
éter etóxi-etano ou éter comum ou éter dietílico
SUA UTILIZAÇÃO É FEITA EM PACIENTES, É UM PODEROSO ANESTÉSICO INALATÓRIO PORQUE RELAXA OS MÚSCULOS, MAS POSSUI AS DESVANTAGENS DE CAUSAR IRRITAÇÃO NO TRATO RESPIRATÓRIO E A POSSIBILIDADE DE PROVOCAR EXPLOSÕES EM AMBIENTES FECHADOS.
Sendo assim, ele está em desuso, apesar de ter sido usado durante quase um século.
O éter etílico dissolve graxas, óleos e resinas, por isso é usado na indústria como solvente de óleos e tintas.
Exemplos de éteres:
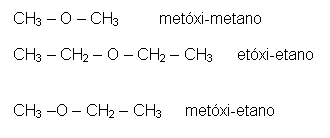
ÉSTERES:
Nos ésteres (função éster), o hidrogênio da carboxila (COOH) dos ácidos carboxílicos( lembra: final de cadeia) é substituído por um radical orgânico (‒R). Quando esse processo ocorre formando um éster cíclico, temos a formação de uma lactona.
Os ésteres têm várias aplicações, como solventes, polímeros ( poliéster)), medicamentos (o ácido acetil salicílico – AAS, por exemplo, tem uma função éster), flavorizantes (na indústria alimentícia e de medicamentos).
Os ésteres de massa molecular pequena são líquidos incolores e voláteis, de odor agradável. Conforme a quantidade de carbonos vai aumentando, a viscosidade do éster também aumenta, podendo chegar ao estado sólido (ceras). São insolúveis em água e solúveis em solventes apolares.
Abaixo, vemos alguns exemplos de ésteres utilizados como flavorizantes:

Flavorizantes: como já mencionado, os flavorizantes são substâncias que apresentam sabor e aroma característicos, geralmente agradáveis. São bastante utilizados em vários produtos alimentícios, como balas, gomas de mascas, sorvetes, bombons, gelatinas, iogurtes, bolos e etc. Alguns exemplos:
- Etanoato de pentila – aroma de banana.
- Butanoato de etila – aroma de morango.
- Etanoato de isopentila – aroma de pera.
- Etanoato de octila – aroma de laranja.
- Etanoato de benzila – aroma de jasmim.
- Nonanoato de etila – aroma de rosa.
- Metanoato de etila + heptanoato de etila – aroma de uva.
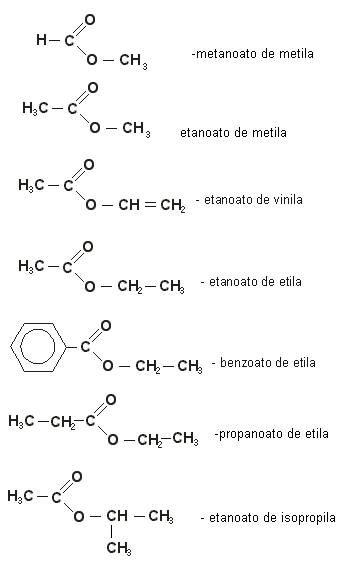
NOMENCLATURA DOS ÉSTERES:
Eles tem um nome que apresenta “oato” para a primeira parte ( antes do C=O) e “ila” para a segunda parte, depois do C=O.

ÉSTERES IMPORTANTES:
Os ésteres estão presentes na produção dos polímeros conhecidos como poliésteres, que são formados pela reação entre um diácido carboxílico (ácido tereftálico) e um diálcool (etilenoglicol). O principal poliéster é o polímero PET.
Esse polímero é usado na produção de embalagens, principalmente de garrafas, guarda-chuvas, barracas de camping, na produção de fibras têxteis sintéticas, entre outros.

O poliéster é um polímero usado na fabricação de fibras têxteis sintéticas
Outra das principais aparições dos ésteres em nosso cotidiano ocorre nos óleos e gorduras, que são, na verdade, triésteres, ou seja, como o próprio nome indica, suas moléculas possuem três grupos de ésteres. Eles são formados pela reação entre o glicerol (um triálcool) e ácidos graxos (ácidos carboxílicos de cadeia bem longa), com eliminação de água. Visto que são derivados da glicerina (glicerol), eles são também chamados de triglicerídeos:

Reação de obtenção de um triglicerídeo
Se as ligações entre os grupos orgânicos simbolizados por “R” acima forem todas simples, ou seja, se o triéster derivar de um ácido graxo saturado, teremos a formação de uma gordura, como a manteiga. Mas se o ácido graxo for insaturado, com ligações duplas entre carbonos, então, teremos óleos.

Os óleos e gorduras são triésteres
ASSISTA AO VÍDEO E TIRE SUAS DÚVIDAS!

